在标准状况下,进行甲、乙、丙三组实验。三组实验各取30 ml.同浓度的盐酸,加入同
一种镁、铝混合物粉末,产生气体,有关数据列表如下:

(1)甲、乙两组实验中,哪一组盐酸是不足量的? (填“甲”或“乙”)。理由是
(2)计算盐酸的物质的量浓度;(写出计算过程)
(3)求混合粉末中Mg、Al的物质的量之比?(写出计算过程)
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选用酚酞作指示剂。请填写下列空白:
(1)酸式滴定管用蒸馏水洗涤后,直接注入标准盐酸溶液进行滴定,则测得的结果________(填“偏高”、“偏低”或“无影响”)。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察____________。
A. 滴定管内液面的变化 B. 锥形瓶内溶液颜色的变化
(3) 滴定结果如下表所示:
| 滴定次数 |
待测溶液NaOH的 体积/mL |
标准盐酸溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
0.00 |
26.11 |
| 2 |
25.00 |
1.56 |
30.30 |
| 3 |
25.00 |
0.22 |
26.31 |
若盐酸标准溶液的浓度为0.1000 mol·L-1,则该NaOH溶液的物质的量浓度为_________ mol·L-1。
汽车发生强烈碰撞时,安全气囊内的NaN3发生化学反应生成氯化钠(Na3N)与氮气,所产生的气体快速充满气囊,可以达到保护车内人员的目的。
(1)请写出上述反应方程式: ;它的基本反应类型是 。
(2)若安全气囊内含有195gNaN3,其物质的量为 。
(3)若195gNaN3完全分解,在标准状况下,气囊膨胀的体积约为 。
(4)28gKOH固体必须溶解在 g水中,才能使每200个水分子中有1个K+。
(5)Mg能在O2、N2、CO2中燃烧,写出镁在CO2中燃烧的化学方程式 。
(1)0.5 mol CO2的质量为___________,其中含有__________个CO2分子,在标准状况下的体积是 。
(2)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为____________。
(3)想一想:Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液体)这三种物质为什么可以归为一类,下列哪些物质可以和它们归为一类 (填序号)。
A 75%的酒精溶液 B 硝酸钠 C 碱石灰 D 豆浆 E 过氧化钠
(4)洁厕灵(强酸性,含盐酸)与84消毒液(碱性,含NaClO)混用可能使人中毒。请写出中毒涉及反应的离子方程式 。
(1)将117 g NaCl溶于水配制成1 L溶液,该溶液中NaCl的物质的量浓度为 。
(2)在标准状况下,将V L A气体(摩尔质量为M)溶于0.1 L水中,所得溶液的密度为,则此溶液的物质的量浓度为 。
(3)某硫酸溶液的物质的量浓度为c1,密度为ρ1;另一种硫酸溶液的物质的量浓度为c2,密度为ρ2,将它们等体积混合后,所得溶液的密度为ρ3,则混合后硫酸的物质的量浓度为 。
A.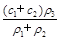 |
B.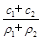 |
C.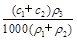 |
D.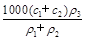 |
(1)AlCl3溶液与NaOH溶液反应时,当Al3+的物质的量与OH-的物质的量之比(以下均填物质的量之比)为________时,Al(OH)3沉淀量最多。
(2)NaAlO2溶液与盐酸溶液反应时,AlO的物质的量与H+的物质的量之比为________时,Al(OH)3沉淀恰好溶解。
(1)MgCl2的摩尔质量是 ;0.1mol CO2在标准状况下体积约是 ;0.2 mol·L-1的Cu(NO3)2溶液中NO3-的物质的量浓度是 。
(2)现有以下物质:①熔融NaCl ②液氨 ③醋酸水溶液 ④HCl气体 ⑤酒精(C2H5OH)。请用相应序号填空:能导电的是 ;属于电解质的是 。
(3)CH3COOH的电离方程式为 。
Na2O2可作为潜水艇里氧气的来源。将3.9gNa2O2充分反应。
(1)Na2O2的物质的量为_________mol。
(2)生成的O2在标准状况下的体积为___________L。
(3)反应中转移的电子数为________(NA为阿伏加德罗常数的值)。
标准状况下4.48 L HCl的质量是__________g,将其溶于水配成100mL的溶液,所得溶液的物质的量浓度为 mol/L。
按要求填空:
(1)除去下列物质中所混有的少量杂质,写出有关的反应方程式。
①Fe2O3中混有少量SiO2 ;
② NO中混有NO2 。
(2)为什么不能用加热NH4Cl固体的方式制取氨气(用化学方程式表示): 。
(3)将1.92g Cu投入到100mL某浓度的硝酸溶液中,观察到产生红棕色气体,随着反应的进行,气体颜色逐渐变浅。铜完全反应完后,共收集到1.12L气体(标准状况下测定),则此时参与反应且未被还原的硝酸物质的量为 ;所产生的气体中NO2的体积分数为 。
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:

(1)混合物中NaOH的质量是 g,AlCl3的质量是 g。
(2)P点所表示盐酸加入体积为 mL。
按要求填空:
(1)含有相同氧原子数的CO2和CO:物质的量之比为___________;质量之比为______________。
(2)写出除去FeCl3溶液中的FeCl2所需的试剂:_______________(填化学式)
(3)海水的溴以Br-的形式存在,海水中提溴的方法通常是:向苦卤中通入Cl2是为了提取Br2,为
大量富集Br2,常先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收,该反应的离子方程式是 。
(1)13.2g氮的氧化物(NxO)中氧原子物质的量为0.3mol,该质量的NxO在标况下的体积为__________L,x的值为_________。
(2)化合物A的分子组成可用NxHy表示,在一定条件下可发生分解反应,15mLA气体完全分解生成5mL N2和20mL NH3(同温、同压)。A的化学式为_________________。
(3)20mL Al2(SO4)3溶液加水稀释至100mL,稀释后的溶液中SO42-的物质的量浓度为0.3mol∙L-1。则稀释前Al2(SO4)3的物质的量浓度为________________。
实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,现取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
请回答下列问题:
(1)写出该反应的离子反应方程式______________________。
(2)参加反应的二氧化锰的质量为____________。
(3)反应中被氧化的HCl的物质的量为 ____________。
(1)某氯化镁溶液的密度为d g·cm-3,其中镁离子的质量分数为A%,则300 mL该溶液中c (Cl-)= (mol/L)。
(2)无土栽培中,需配制营养液NaH2PO4、Na2HPO4(物质的量之比为4 : 1),已知每升含磷元素0.10mol,现用4.0mol/LH3PO4和固体NaOH配制2 L该营养液需要:
V(H3PO4)= (mL),m(NaOH)= (g)。
(3)甲、乙两烧杯中各成盛有100mL 3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为 甲 : 乙=1 : 2,则加入铝粉的质量为: (g)。
试题篮
()