广义的化学反应速率可以用参加化学反应的任一种物质“在单位时间内某一可测的物理量的变化量”来表示,即V(A) =  ,rX(A)表示物质A物理量(如质量、浓度等)的改变量。某学习小组用块状纯锌和200mL稀硫酸反应研究化学反应速率,实验装置图如右图。
,rX(A)表示物质A物理量(如质量、浓度等)的改变量。某学习小组用块状纯锌和200mL稀硫酸反应研究化学反应速率,实验装置图如右图。
可选用试剂及规格:纯锌、粗锌(含铜杂质)、1mol/L 稀硫酸、2mol/L 稀硫酸,
反应温度:250C 、350C
(1)请写出锌和硫酸反应的离子方程式
(2)为表达锌和硫酸反应快慢,该学习小组设计了如下表格,请填充表格丁、戊、己三处。
| 编号 |
反应速率表达式的定义 |
反应速率表达式 |
反应速率单位 |
| ① |
单位时间内H+浓度的变化量 |
V(H+) = |
mol / L.min |
| ② |
丁 |
戊 |
己 |
| ③ |
单位时间内生成H2标况下的体积 |
V(H2) = 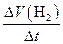 |
L / min |
(3)该学习小组选用0.1 mol Zn和200 mL 1mol/L 稀硫酸(硫酸过量)在250C反应进行研究,用秒表计时,至锌块完全溶解且溶液中不再有气泡放出时,记录反应时间为5分钟,该反应速率V(H+) =
(4)该小组对“影响反应速率的因素”进行了分析,设计如下系列实验,庚辛壬癸四处空白。
| 编号 |
锌的形状 |
锌的规格 |
硫酸的浓度 |
反应温度 |
实验设计的目的 |
| ① |
块状 |
纯锌 |
1mol/L |
250C |
实验①和②研究的目的是 庚 ; 实验②和③研究硫酸浓度对反应速率影响; 实验③和④研究锌的规格对反应速率影响; 实验④和⑤研究的目的是 癸 ; |
| ② |
颗粒状 |
纯锌 |
1mol/L |
250C |
|
| ③ |
颗粒状 |
纯锌 |
辛 |
250C |
|
| ④ |
颗粒状 |
壬 |
2mol/L |
250C |
|
| ⑤ |
颗粒状 |
粗锌 |
2mol/L |
350C |
|
| …… |
化学世界奥妙无穷,物质之间的反应更是神秘莫测,善于透过现象看本质是学习化学、研究物质性质的基本能力。请我们一起进行探索。
(1)课堂上化学老师将干燥的氯气依次通过干燥红布条和潮湿的红布条,结果:干燥红布条无明显变化,而潮湿的红布条褪色。
①某学生立即发言:结论一、 ,
结论二、氯气与水反应生成的次氯酸具有漂白性。
②老师提示说:还需要补充一个实验才能得知结论二,该实验是
③请写出氯气与水反应的离子方程式
(2)某实验小组用铜和浓硝酸反应制备NO2,并收集一试管NO2气体,将集气瓶倒置于水槽中,并轻微振荡,发现一些典型现象,并对此现象进行探究。
①请写出NO2与水反应化学方程式,并用单线桥表示电子转移方向和数目
②该小组成员积极探讨,得出结论,NO2与水一定发生了化学反应,并设计了两个实验操作对产物进行了验证,得出产物是NO 和HNO3。请填写下表中的甲、乙、丙三处。
| 实验操作 |
实验现象 |
实验结论 |
| 用玻璃片将水槽中的试管口盖住,轻轻将试管取出 |
试管内约有2/3体积的水溶液,且无色 |
NO2与水发生了化学反应,而不是溶于水 |
| 将试管正立,取下玻璃片 |
甲 |
NO2和水反应生成了NO气体 |
| 乙 |
丙 |
NO2和水反应生成了硝酸 |
下列有关化学研究的正确说法是
| A.化学家提出的假设不一定能被实验证实 |
| B.同时改变两个变量来研究反应速率的变化,能更快得出有关规律 |
| C.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增的规律 |
| D.科恩和波普尔因理论化学方面的贡献获诺贝尔化学奖,标志着化学已成为以理论研究为主的学科,不需要再做化学实验 |
为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。试填空。
(1)D装置中主要反应的离子方程式为 ,
F仪器的作用是: 。
(2)为验证通入D装置中气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试剂:
a 氯化铁稀溶液 b 氯化亚铁溶液 c硫氰化钾溶液
d 苯酚溶液 e 品红溶液 f 酸性高锰酸钾溶液
①若Cl2过量:取盛有 (选填一个符号)试剂的试管, 加入 (选
填一个符号)试剂,无明现象,再取适量D中溶液滴加至试管中,发生的现象
是: ;
② 若选用上述试剂中的一种结合必要的操作就可以验证通入C装置中气体是Cl2过量
还是SO2过量,该试剂是______(选填一个符号),必要操作和结论______ ____。
目前世界上60%的镁是从海水中提取的。学生就这个课题展开了讨论的。已知海水提镁的主要步骤如下:
学生就这个课题提出了以下问题:
(一)在海水提镁的过程中如何实现对镁离子的富集?
有三个学生提出自己的观点。
学生甲的观点:直接往海水中加入沉淀剂。
学生乙的观点:高温加热蒸发海水后,再加入沉淀剂。
学生丙的观点:利用晒盐后的苦卤水,再加入沉淀剂。
请你评价三个学生提出的观点是否正确(填是或否),并简述理由。
| |
是否正确 |
简述理由 |
| 学生甲的观点 |
|
|
| 学生乙的观点 |
|
|
| 学生丙的观点 |
|
|
(二)在海水提镁的过程中如何实现对镁离子的分离?
(1)为了使镁离子沉淀下来,加入的足量试剂①是 (填化学式)。
(2)加入的足量试剂②是 (填化学式)。
(3)试从节约能源,提高金属镁的纯度分析,以下适宜的冶镁方法是 。
A. |
B. |
C. |
D. |
.某研究性学习小组为了探究镁粉与溴水反应的机理,做了如下四种实验:①将镁粉投入到冷水中,未观察到明显现象;②将镁粉投入到溴水中,观察到只是开始时产生极少量的气泡,但溴水会慢慢退色;③将镁粉投入到液溴中,未观察到明显现象;④向含有足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快退去。下列关于镁粉与溴水的反应机理的叙述中正确的是
| A.镁粉只直接与溴水中的溴反应 | B.镁粉只与溴水中的酸反应 |
| C.产生极少量的气泡是由于镁粉与水反应得到的 | D.镁粉在水的催化下与溴发生反应 |
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,终读数如图所示。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,终读数如图所示。请回答下列问题:
(1)称量样品所用的仪器为_____,将样品研细后再反应,其目的是_______。
(2)装置A的作用是________。
a.有利于空气中氧气充分反应 b.除去空气中的水蒸气
c.有利于气体混合 d.有利于观察空气流速
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)滴定时,标准碘溶液所耗体积为_________mL。
判断滴定已达终点的现象是_______。
通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____。(填编号)
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_____________________________________________。
根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量么(近似值)的实验。先称量反应物氧化铜的质量
(
),反应完全后测定生成物水的质量

(
),由此计算
。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的
与
的量足以产生使
完全还原的氨气):

请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)→;
(3)在本实验中,若测得(
)="
"
,
(
2
)= "
"
,则
=;
(4)在本实验中,使测定结果偏大
 的是 (填序号);
的是 (填序号);
①未完全起反应 ②
不
 干燥
干燥
③中混有不反应的杂质 ④碱石灰不干燥
⑤与
混合物不干燥
(5)在本实验中,还可通过测定和,或和达到实验目的。
某兴趣小组用题图装置探究氨的催化氧化.

(1)氨催化氧化的化学方程式为.
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是反应(填"吸热"或"放热").
(3)为保证在装置4中观察到红棕色气体,装置3应装入;若取消3,在4中仅观察到大量白烟,原因是.
(4)为实现氨催化氧化,也可用装置5替换装置(填装置代号);化合物为(只写一种),
的作用是.
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是。
(2)另称取铁钉6.0放入15.0
.浓硫酸中,加热,充分应后得到溶液
并收集到气体
。
①甲同学认为中除
外还可能含有
。若要确认其中的
,应先用选填序号)。
a.溶液和氯水 b.铁粉和
溶液 c.浓氨水 d.酸性
溶液
②乙同学取336(标准状况)气体Y通入足量溴水中,发生反应:
然后加入足量
溶液,经适当操作后得干燥固体2.33
。由于此推知气体
中
的体积分数为。
[探究二]
分析上述实验中体积分数的结果,丙同学认为气体Y中还可能含量有
和
气体。为此设计了下列探究实验状置(图中夹持仪器省略)。

(3)装置中试剂的作用是
(4)认为气体中还含有
的理由是(用化学方程式表示)。
(5)为确认的存在,需在装置中添加
于(选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体中含有
,预计实验现象应是
(7)若要测定限定体积气体中
的含量(标准状况下约有28
),除可用测量
体积的方法外,可否选用质量称量的方法?做出判断并说明理由。
某科研小组用和浓盐酸制备
时,利用刚吸收过少量
的
溶液对其发扬进行吸收处理。
(1)请完成与过量
溶液反应的化学方程式:
+2
=。
(2)反应中的还原剂为。
(3)吸收尾气一段时间后,吸收液(强碱性)肯定存在和
。请设计实验,探究该吸收液中可能存在的其它离子(不考虑空气的
的影响)
①提出合理假设
假设1:只存在
假设2:既不存在也不存在
假设3:
②设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3、1
、0.01
、淀粉-
溶液、紫色石蕊试液.
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3 |
 |
| 步骤2: |
|
| 步骤3: |
用右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是

| A. |
上下移动①中铜丝可控制
|
| B. |
②中选用品红溶液验证
|
| C. |
③中选用
|
| D. |
为确认
|
某研究性学习小组在网上收集到如下信息:溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是。
a. 边振荡盛有2%的溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配置过程中,溶液的增大
【提出假设】
假设1:具有氧化性,能氧化
。
假设2:溶液显酸性,在此酸性条件下
能氧化
。
【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出,验证了假设1的成立。请写出
氧化
的离子方程式:。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:在不同条件下的还原产物较复杂,有时难以观察到气体产生)。

【思考与交流】
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论:溶液中的
和
都氧化了
。你是否同意丙同学的结论,并简述理由:。
某同学为探究碳酸钠的性质,进行了如下实验,请你按要求回答有关问题。
(1)配制100 mL 0.5 mol/L的Na2CO3溶液。该同学先用天平称量Na2CO3固体的质量,然后配制该溶液,要用到的玻璃仪器有量筒、烧杯、 、 。
(2)用pH试纸测所配溶液的pH,pH>7,说明Na2CO3溶液呈 (填“酸性”、“碱性”或“中性”);用试管取少量所配溶液,向溶液中滴加几滴酚酞试液,溶液变红,再用酒精灯加热,溶液的颜色变深,说明升高温度,对Na2CO3的水解有 作用。
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应.2NO2+2NaOH=NaNO3+NaNO2+H2O (1)装置①中发生反应的离子方程式是 .
(2)装置②的目的是 ,发生反应的化学方程式是 .
(3)实验应避免有害气体排放到空气中,装置③、④、⑤、⑥中盛放的药品依次是
.
(4)实验的具体操作是:先检验装置的气密性,再加入药品,然后打开弹簧夹,通入
目的是 .
(5)该小组得出的结论所依据的实验现象是 .
试题篮
()