白藜芦醇结构如下式, 它广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性。能够与1mol该化合物起反应的Br2或H2的最大用量分别是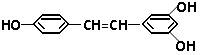
| A.6mol,7mol | B.5mol,7mol |
| C.3.5mol,6mol | D.1mol,1mol |
2006年4月30日出现的亮菌甲素注射液引起多人中毒死亡的恶性事件。假药生产中原辅料中应有的“丙二醇” 被换成廉价而有毒的化工原料“二甘醇”是致病人死亡的重要原因。二甘醇的结构简式是HO—CH2CH2—O—CH2CH2—OH。下列有关二甘醇的叙述正确的是
被换成廉价而有毒的化工原料“二甘醇”是致病人死亡的重要原因。二甘醇的结构简式是HO—CH2CH2—O—CH2CH2—OH。下列有关二甘醇的叙述正确的是
| A.不能与金属钠发生反应 | B.能发生取代反应 |
| C.不能溶于水和乙醇 | D.符合通式Cn H2nO3 |
将0.1 mol乙二醇完全燃烧后的所有产物全部通入过量的石灰水中,完全被吸收,经过滤得到20 g沉淀。滤液的质量比原石灰水的质量减少了 ( )
| A.5.4 g | B.5.8 g | C.11.2 g | D.14.2 g |
实验室里浓硫酸与酒精的混合物在一定条件下可制得乙烯。请选用如下装置,验证所生成的乙烯中混有CO2及SO2气体

(1)实验室制乙烯时,浓硫酸与酒精按 体积比混合,生成乙烯的化学方程式是 。
(2)按气体流向从左→右,则各装置的接口次序是 。
(3)能证明生成的乙烯中混有SO2气体的实验现象是: ;
(4)能证明生成的乙烯中混有CO2气体的实验现是:
。
(5)在制气装置中,最终反应混合物的颜色变成 色
当乙醇分子中的氧原子被硫原子代替后即为乙硫醇(C2H5SH),乙硫醇的沸点为36.2℃,而乙醇(C2H5OH)的沸点为78.4℃。以下能对两者沸点差异作正确解释的是
| A.相对分子质量的大小 | B.共价键的强弱 | C.氢键 | D.结构的相似性 |
某同学在学习乙醇的知识后,设计了如下的实验。操作步骤为:
①在试管里加入2 mL 乙醇;
②把一端弯成螺旋状的铜丝放在酒精灯外焰中加热;
③立即将铜丝插入盛有乙醇的试管里(如图),反复操作几次;
④闻生成物的气味,观察铜丝表面的变化。
试回答下列问题:
⑴该实验的目的是 ;
⑵第④步操作中,能闻到 气味;
⑶写出反应的化学方程式 。
有机物A的分子式为C3H8O,它能氧化成B,也能与浓H2SO4共热生成C。 若B不能发生银镜反应,C不能使溴水褪色,分别写出A、B、C的结构简式
0.2 mol有机物和0.4 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过灼热CuO充分反应后,固体质量减轻3.2 g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6 g。
(1)判断该有机物的化学式。
(2)若0.2 mol该有机物恰好与4.6 g金属钠完全反应,试确定该有机物的结构简式。
下列关于醇和酚的说法中,正确的是
| A.含有羟基的化合物一定是醇 |
| B.分子内有苯环和羟基的化合物一定是酚 |
| C.表示醇类的官能团是跟链烃基相连的羟基 |
| D.酚和醇具有相同的官能团,因而具有相同的化学性质 |
下列有机反应中都需使用浓硫酸,试填浓硫 酸和乙醇在170℃共热,其作用是_______________________________,该反应的化学方程式为__________________________________________
酸和乙醇在170℃共热,其作用是_______________________________,该反应的化学方程式为__________________________________________
如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子。则该物质不具有的性质是
| A.使紫色石蕊变红 | B.与钠反应 |
| C.发生酯化反应 | D.发生氧化反应 |
试题篮
()