已知反应FeO(s)+CO(g)===CO2(g)+Fe(s)的ΔH>0,ΔS>0(假定它们都不会随温度的改变而改变),下列叙述中正确的是( )
| A.低温下为自发过程,高温下为非自发过程 |
| B.低温下为非自发过程,高温下为自发过程 |
| C.任何温度下均为非自发过程 |
| D.任何温度下均为自发过程 |
根据热化学方程式:S(s)+O2(g)===SO2(g) ΔH=a kJ· mol-1(a=-297.2)。分析下列说法,其中不正确的是( )
| A.S(s)在O2(g)中燃烧的反应是放热反应 |
| B.S(g)+O2(g)===SO2(g) ΔH=b kJ·mol-1,则a<b |
| C.1 mol SO2(g)所具有的能量低于1mol S(s)与1mol O2(g)所具有的能量之和 |
| D.16 g固体硫在空气中充分燃烧,可放出148.6 kJ的能量 |
下列叙述中一定能判断某化学平衡发生移动的是( )
| A.混合物中各组分的浓度改变 |
| B.正、逆反应速率改变 |
| C.混合物中各组分的含量改变 |
| D.混合体系的压强发生改变 |
下列有关说法正确的是( )
| A.CaCO3(s)===CaO(s)+CO2(g)在室温下不能自发进行,说明该反应的ΔH<0 |
| B.焓变和熵变是判断反应方向的两个主要因素 |
C.N2(g)+3H2(g) 2NH3 ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 2NH3 ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D.任何情况下,温度都不可能对反应的方向起决定性作用 |
下列事实能说明亚硝酸是弱电解质的是( )
①25℃时亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电试验,灯泡很暗 ③HNO2溶液不与Na2SO4溶液反应 ④0.1 mol·L-1 HNO2溶液的pH=2.1
| A.①②③ | B.②③④ | C.①④ | D.①②④ |
下列说法正确的是( )
| A.需要加热才能发生的反应一定是吸热反应 |
| B.化学反应中的能量变化都表现为热量变化 |
| C.任何放热反应在常温下一定能发生 |
| D.反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
室温下,对于0.10mol·L-1的氨水,下列判断正确的是( )
| A.与AlCl3溶液发生反应的离子方程式为Al3++3OH-===Al(OH)3↓ |
| B.加水稀释后,溶液中c(NH4+)·c(OH-)变大 |
| C.用HNO3溶液完全中和后,溶液不显中性 |
| D.其溶液的pH=13 |
用石墨做电极电解CuSO4溶液。通电一段时间后,欲使电解液恢复到起始状态,应向溶液中加入适量的( )
| A.CuSO4 | B.H2O | C.CuO | D.CuSO4·5H2O |
在下列各说法中,正确的是( )
A.对于2SO2(g)+O2(g) 2SO3(g) ΔH=-Q kJ· mol-1(Q>0),若反应中充入2 mol SO2(g)和足量的氧气反应时,放出的热量一定是Q kJ 2SO3(g) ΔH=-Q kJ· mol-1(Q>0),若反应中充入2 mol SO2(g)和足量的氧气反应时,放出的热量一定是Q kJ |
| B.热化学方程式中的系数表示物质的量,不能用分数表示 |
| C.电镀时,镀件做阴极,含有镀层金属阳离子的溶液做电镀液 |
| D.已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6kJ· mol-1,1 mol氢气完全燃烧放出的热量为571.6kJ |
为探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol·L-1)反应过程中的热效应,实验测得如下数据:
| 序号 |
35 mL试剂 |
固体 |
混合前 温度/℃ |
混合后 温度/℃ |
| ① |
水 |
2.5 g NaHCO3 |
20.0 |
18.5 |
| ② |
水 |
3.2 g Na2CO3 |
20.0 |
24.3 |
| ③ |
盐酸 |
2.5 g NaHCO3 |
20.0 |
16.2 |
| ④ |
盐酸 |
3.2 g Na2CO3 |
20.0 |
25.1 |
由此得出的结论正确的是( )
A.Na2CO3溶液与盐酸的反应是吸热反应
B.NaHCO3溶液与盐酸的反应是放热反应
C.20.0℃时,含3.2g Na2CO3的饱和溶液和35mL盐酸混合后的温度将低于25.1℃
D.20.0℃时,含2.5g NaHCO3的饱和溶液和35mL盐酸混合后的温度将低于16.2℃
有机物在燃烧过程中会释放出热能,为放热反应;相反,自然界由光合作用生成有机物的过程中需要吸收能量。研究表明,化学反应中的能量变化其本质是化学键的生成或断裂过程中分别会释放与吸收能量。如图表示反应2H2(g)+O2(g)===2H2O(g)的能量变化,下列有关说法中错误的是( )
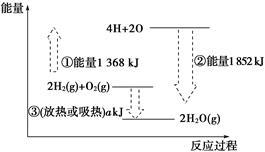
| A.图中的①是指吸收能量,②是指放出能量 |
| B.图示说明反应2H2(g)+O2(g)===2H2O(g)是一个吸热反应 |
| C.图示说明化学键的形成与断裂是物质在化学反应中发生能量变化的主要原因 |
| D.③中a所指的数值为484 |
下列反应在任何温度下均能自发进行的是( )
| A.2N2(g)+O2(g)═2N2O(g)△H=+163kJ•mol-1 |
| B.Ag(s)+ Cl2(g)═AgCl(s)△H=-127kJ•mol-1 |
| C.HgO(s)═Hg(l)+O2(g)△H=+91kJ•mol-1 |
| D.H2O2(l)═O2(g)+H2O(l)△H=-98kJ•mol-1 |
试题篮
()