将钠放置在空气中,是生成白色的Na2O还是淡黄色的Na2O2,主要取决于下列因素中的
| A.反应温度 | B.空气的量 | C.钠粒的大小 | D.钠的形状 |
下列常用食品添加剂不属于电解质的是
| A.NaCl | B.C2H5OH | C.CH3COOH | D.NaHCO3 |
对溶液、浊液、胶体的下列叙述错误的是
| A.都呈电中性 | B.都是混合物 |
| C.本质区别是分散质微粒直径大小 | D.都能透过滤纸 |
把5.1 g镁铝合金的粉末放入过量的300 mL 2 mol·L-1盐酸中,得到5.6 L H2(标准状况下)。试计算:
(1)该合金中铝和镁的物质的量之比。
(2)在反应后的溶液中加入4 mol·L-1 NaOH溶液,若要使沉淀量达到最大值,则加入的NaOH溶液的体积为多少?
有一包白色粉末状混合物,可能含有K2CO3、CuSO4、AlCl3、NaOH中的某几种,现进行如下实验:
① 将混合物溶于水,得到无色透明溶液。
② 取少量上述溶液两份:
第一份中加入稀硝酸,开始出现白色沉淀,有气泡产生,继续加入稀硝酸,沉淀全部溶解,再加入AgNO3溶液,又出现白色沉淀;
第二份进行焰色反应,直接观察,火焰呈黄色。
根据上述实验现象回答:
(1)原混合物中肯定有 。
(2)第一份中,继续加入稀硝酸,沉淀全部溶解的离子方程式为 。
(3)第一份中,再加入AgNO3溶液,又出现白色沉淀的离子方程式为 。
(4)第二份进行焰色反应,为什么观察不到K+的焰色反应 。
某工业废水中含有大量的FeSO4、较多的Cu2+和少量的Fe3+。为了较少污染并变废为宝,拟从该废水中回收硫酸亚铁和金属铜,其流程如下图。请完成下列问题。
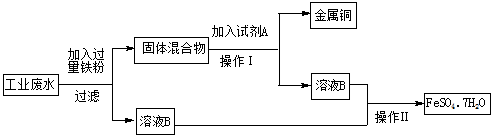
(1)检验工业废水中含有Fe3+的方法是 。
(2)工业废水中加入过量铁粉时,有Fe3+参加的离子反应方程式为 。
(3)操作Ⅰ为 。
在如下图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2。
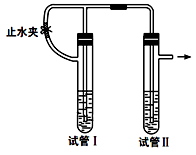
(1)在试管I中加入的试剂是 。
(2)为了制得Fe(OH)2白色沉淀,在试管I和Ⅱ中加入试剂,打开止水夹,塞紧塞子后观察到试管I产生大量气体。一段时间后,检验到试管Ⅱ支管出口的气体只有一种时,再进行的操作是 ,使试管I中的溶液进入到试管Ⅱ中溶液底部,产生Fe(OH)2。
(3)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
(4)反应结束后,将Fe(OH)2沉淀倒出,在空气中迅速变为灰绿色,最后变为红褐色,其原因是 (用化学方程式表示)。
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。根据图示判断下列说法不正确的是
| A.实验进行时试管A中应加入的试剂是普通铁粉 |
| B.烧瓶B的作用是防止倒吸,烧瓶C的作用是产生水蒸气 |
| C.试管D中收集得到的是H2 |
| D.3 mol单质Fe全部转变为Fe3O4,失去8 mol电子 |
下列说法正确的是
| A.1 mol任何气体的摩尔体积都约是22.4 L |
| B.标准状况时,体积均为22.4 L的O2与CO2含有相同的分子数 |
| C.处于标准状况的两种气体,当体积均为22.4 L时的质量完全相同 |
| D.标准状况时,2 mol任何物质的体积均约为44.8 L |
下列有关胶体和溶液的比较中,正确的是
| A.可用滤纸过滤除去溶液中的胶体粒子 |
| B.溶液中溶质的粒子运动有规律,胶体粒子运动无规律 |
| C.一束光线通过溶液没有特殊现象,一束光线通过胶体时出现光亮的“通路” |
| D.通直流电后,溶液中溶质的粒子分别向两极运动,而胶体中分散质的粒子向某一极运动 |
下列反应中,既属于氧化还原反应又属于置换反应的是
A.CuO+H2  Cu+H2O Cu+H2O |
| B.CO2+Ca(OH)2=CaCO3↓+H2O |
C.Fe2O3+3CO  2Fe+3CO2 2Fe+3CO2 |
D.2Na+Cl2 2NaCl 2NaCl |
对合金的性质或应用,下列说法不正确的是
| A.合金的硬度一般比它的各成分金属的小,多数合金的熔点一般也比它的各成分金属的高 |
| B.合金在工业上具有比纯金属更广泛的用途 |
| C.制饭勺、饭盒、高压锅等的不锈钢是合金 |
| D.青铜是我国使用最早的合金 |
下列物质分类正确的是
| A.Na2O2、Fe3O4、CuO均为碱性氧化物 |
| B.稀豆浆、硅酸、氯化铁溶液均为胶体 |
| C.烧碱、冰醋酸、四氯化碳均为电解质 |
| D.盐酸、水玻璃、氨水均为混合物 |
进行化学实验时应强化安全意识。下列做法正确的是
| A.金属钠着火时使用泡沫灭火器灭火 |
| B.用试管加热碳酸氢钠固体时使试管口竖直向上 |
| C.蒸馏实验时向蒸馏瓶中放入几粒沸石(或碎瓷片) |
| D.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 |
硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2。850℃~950℃时,空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):4FeS2+11O2→2Fe2O3+8SO2
(1)含硫35%的硫铁矿样品(杂质不含硫),其FeS2的含量为 。
(2)设1t纯净的FeS2完全反应,产生标准状况下SO2 m3。
(3)为使FeS2煅烧完全生成Fe2O3,工业上使用过量空气,当空气过量20%时,所得炉气中SO2的体积分数为多少?
试题篮
()