已知:
①不对称烯烃与不对称加成物在不同的条件下有不同的加成方式,如:
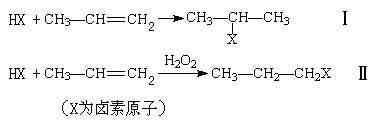
②烃基上的卤素原子在一定条件下能发生取代反应,如:
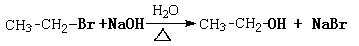
也能发生消去反应,如:
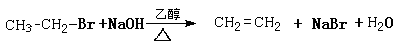
对溴苯乙烯(Br CH=CH2)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点。
CH=CH2)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点。
完成下列填空:
(1)写出该共聚物的结构简式
(2)实验室由乙苯制取对溴苯乙烯,需先经两步反应制得中间体Br CHBrCH3。
CHBrCH3。
写出该两步反应所需的试剂及条件。
(3)将Br CHBrCH3与足量氢氧化钠溶液共热得到A,得到A时,苯环上没有化学键的断裂和生成。
CHBrCH3与足量氢氧化钠溶液共热得到A,得到A时,苯环上没有化学键的断裂和生成。
写出生成A的化学方程式 。
由上述反应可推知 。
由A生成对溴苯乙烯的反应方程式为 。
(4)丙烯催化二聚得到2,3-二甲基-1-丁烯,B与2,3-二甲基-1-丁烯互为同分异构体,且所有碳原子处于同一平面。写出B的结构简式。 ,1molB完全燃烧时耗氧___________mol
完成下列获得B的化学方程式(条件错误不得分):
①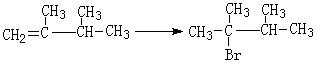
________________________________________________
②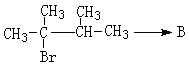
_________________________________________________
请从下图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。
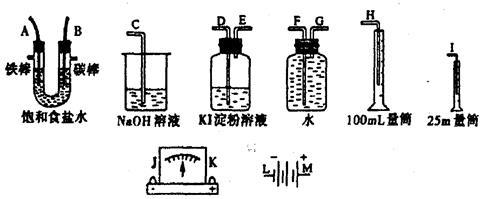
(1)电源、电流表,与A、B两极的正确连接顺序为L→J→K→( )→( )→M。
(2)B极发生的电极反应式是 。简述检验该电极产物的方法和现象 。
(3)设计上述气体实验装置时,各接口的正确连接依序为:检验氯气的氧化性时B接D 、E接C。测定产生的氢气的体积时A接_________、_________接__________。
(4)若电解饱和食盐水50mL,通电为t min时,测得产生的H2体积为 5.6mL(标况),则此时溶液的pH为 。(忽略溶液体积的变化)
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选用酚酞作指示剂。请填写下列空白:
(1)酸式滴定管用蒸馏水洗涤后,直接注入标准盐酸溶液进行滴定,则测得的结果________(填“偏高”、“偏低”或“无影响”)。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察____________。
A. 滴定管内液面的变化 B. 锥形瓶内溶液颜色的变化
(3) 滴定结果如下表所示:
| 滴定次数 |
待测溶液NaOH的 体积/mL |
标准盐酸溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
0.00 |
26.11 |
| 2 |
25.00 |
1.56 |
30.30 |
| 3 |
25.00 |
0.22 |
26.31 |
若盐酸标准溶液的浓度为0.1000 mol·L-1,则该NaOH溶液的物质的量浓度为_________ mol·L-1。
常温下,将0.01 mol CH3COONa 和0.002 molHCl溶于水,形成1L混合溶液:
(1)该溶液中存在三个平衡体系,用电离方程式或离子方程式表示①和②:
① 。
② 。
③CH3COOH CHCOO-+H+。
CHCOO-+H+。
(2)溶液中共有 种不同的粒子(指分子和离子),在这些粒子中,浓度为0.01 mol/L的是 ,浓度为0.002 mol/L的是 。
(3)在上述溶液中,存在的两个守恒关系是:
①物料守恒,C(CH3COO-)+C(CH3COOH)= mol/L;
②电荷守恒,即: 。
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请根据所学知识回答下列问题:
(1)NaHCO3溶液中共存在7种微粒,它们是Na+、HCO3-、H+、CO32-、H2O、 、 。(填写微粒符号)
(2)常温下,物质的量浓度均为0.1mol/L的六种溶液①NH4NO3、②NaCl、③NaClO、④H2SO4、⑤NaOH、⑥CH3COONa,pH从大到小排列顺序为 。(填写溶液的序号)
(3)常温时,AlCl3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(4)常温下,物质的量浓度相同的下列溶液 :①NH4Cl、② (NH4)2SO4、 ③NH3·H2O ④ (NH4)2CO3、⑤ NH4HSO4。溶液中c(NH4+)从大到小的顺序为: 。(填写溶液的序号)
LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:
LiFePO4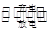 FePO4+Li,电池的正极材料是FePO4,负极材料是石墨和Li(Li嵌在石墨中),含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
FePO4+Li,电池的正极材料是FePO4,负极材料是石墨和Li(Li嵌在石墨中),含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
| A.可加入硫酸以提高电解质的导电性 |
| B.放电时电池内部Li+向负极移动 |
| C.充电过程中,电池正极材料的质量减少 |
| D.放电时电池负极反应为:FePO4+Li++e-= LiFePO4 |
燃烧含硫高的煤和石油是形成酸雨的重要原因,现取放置一段时间的雨水,经分析测得除H+外的各离子浓度为:c(NH4+)=2×10-5mol/L,c(Cl-)=6×10-5mol/L ,c(Na+)=1.9×10-5mol/L ,c(NO3-)=2.3×10-5mol/L, c(SO42-)=2.8×10-5mol/L,则此次酸雨的pH为
| A.3 | B.4 | C.5 | D.6 |
下列说法正确的是:
| A.工业上常使用电解精炼法将粗铜提纯,在电解精练时,阳极减少的质量等于阴极增加的质量 |
| B.心脏起搏器中使用的新型Li-I2电池的寿命已超过10年,其反应可简单表示为2Li+I2=2LiI,阴极反应为:2Li-2e-=2Li+ |
| C.为了降低某水库的铁闸门被腐蚀的速率,其中焊接在铁闸门上的金属材料可以是锌 |
| D.某物质的溶解度为难溶,则该物质不溶于水 |
下列各组离子,在所给的条件下,一定能够大量共存的是
| A.在pH=0的溶液中:Fe2+、Mg2+、CO32-、NO3- |
| B.在由水电离出的c(H+)=1×10-12mol/L的溶液中:HCO3-、Al3+、NH4+、ClO- |
| C.在滴加酸碱指示剂酚酞试液后呈现红色的溶液中:Na+、Cl-、AlO2-、CO32- |
| D.在AlCl3溶液中:K+、NO3-、OH-、Na+ |
如图是表示:2X(g)+Y(g) Z(g)+R(s)+Q(g)的气体反应速率(υ)与时间(t)的关系,
Z(g)+R(s)+Q(g)的气体反应速率(υ)与时间(t)的关系,
t1时开始改变条件,则所改变的条件符合曲线的是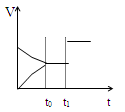
| A.减少Z物质 | B.使用催化剂 | C.升高温度 | D.加大压强 |
常温下,下列混合溶液的pH一定大于7的是
| A.0.01mol/L的盐酸和0.01mol/L的NaOH溶液等体积混合 |
| B.pH=3的盐酸和pH=11的氨水溶液等体积混合 |
| C.0.01mol/L的盐酸和0.01mol/L的氨水溶液等体积混合 |
| D.pH=3的醋酸和pH=11的NaOH溶液等体积混合 |
某学生的实验报告所列出的下列数据中合理的是
| A.用10mL量筒量取7.13mL稀盐酸 |
| B.用pH计测得某稀盐酸的pH为1.54 |
| C.广泛pH试纸润湿后,测得某溶液的pH为2.3 |
| D.用标准的盐酸滴定待测的NaOH溶液时,滴定完毕后,酸式滴定管中盐酸的读数为17.1mL |
25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是
A.2H2(g)+O2(g) ="=" 2H2O(1)△H= ―285.8kJ/mol |
| B.2H2(g)+ O2(g) ="=" 2H2O(1)△H= +571.6 kJ/mol |
| C.2H2(g)+O2(g) ="=" 2H2O(g)△H= ―571.6 kJ/mol |
D.H2(g)+ O2(g) ="=" H2O(1)△H= ―285.8kJ/mol O2(g) ="=" H2O(1)△H= ―285.8kJ/mol |
有关如右图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)
| A.铜片上有气泡逸出 |
| B.反应中,盐桥中的K+会移向CuSO4溶液 |
| C.取出盐桥后,电流计依然发生偏转 |
| D.反应前后铜片质量不改变 |
试题篮
()