下列框图所示的转化关系中,甲为生活中常见的金属单质,乙、丙、丁为气体单质,D为家庭中常用物质(部分反应物和生成物及溶剂水已略去).
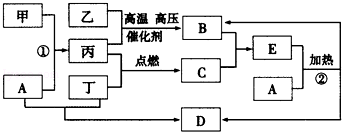
请回答:
(1)E的化学式为 ;甲的原子结构示意图为 ;
(2)反应①的离子方程式为 ;反应②的化学方程式为 ;
(3)实验室制取并收集B的操作中,用 法收集B,验证B已收集满的方法是 (限答一种).
(4)实验室制备丁的方程式为 ,工业上输送丁的管道出现气体泄漏,如何查漏(用方程式表示) .
甲、乙、丙、丁四种物质转化关系如图.已知甲是一种导致钢铁生锈及许多还原性物质变质的单质,化合物乙、丙、丁均含有第三周期一种相同元素R.
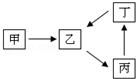
(1)钢铁因甲而生锈时的正极反应式为 .
(2)若乙是难溶于水的酸性氧化物.则
①R的原子结构示意图 .
②乙的一种重要用途是 .
(3)若丙是离子化合物,且阴离子含金属元素R.
①工业上由乙制取R的单质伴随的能量主要转化形式是: 能转化为 能.
②R的单质与MnO2反应的化学方程式为 .
③染料工业排放的废水中含有大量有毒的NO2¯,可以在碱性条件下加入R的单质除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体).除去NO2¯(有丙的阴离子生成)的离子方程式为 .
过氧化钠可作为氧气的来源.常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了14g,反应中有关物质物理量正确的是(NA表示阿伏加德罗常数)
| |
二氧化碳 |
碳酸钠 |
转移的电子 |
| A |
0.5mol |
|
NA |
| B |
|
53g |
0.5mol |
| C |
|
53g |
NA |
| D |
11.2L |
0.5mol |
|
A.A B.B C.C D.D
在0.1mol/L的NaHCO3溶液中,下列关系式正确的是( )
| A.c(Na+)>c(HCO3-)>c(CO32-)>c(OH-) |
| B.c(Na+)+ c(H+)=c(HCO3-)+c(OH-) |
| C.c(H2CO3)+c(H+)=c(OH-)+c(CO32-) |
| D.c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |
已知H2(g)+I2(g)  2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
| A.甲中充入HI气体,乙中不变 | B.甲降低温度,乙增大压强 |
| C.甲中加入0.1 mol He,乙中不变 | D.甲增加0.1 mol H2,乙增加0.1 mol I2 |
在一体积固定的密闭容器中通入2mol A和1mol B,一定条件下发生如下反应:
2A(g)+B(g)  3C(g) ΔH<0,反应达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )
3C(g) ΔH<0,反应达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )

下列有关说法正确的是( )
| A.燃料电池工作时,燃料在负极被还原 |
| B.氯碱工业采用的是以铜为电极,阳离子交换膜来电解饱和食盐水 |
C. 有Mg、Al和NaOH溶液组成的原电池,其负极为铝,电极反应为Al-3e- = Al3+ 有Mg、Al和NaOH溶液组成的原电池,其负极为铝,电极反应为Al-3e- = Al3+ |
| D.二次电池充电时,电池负极连接到外接电源的负极 |
已知:H2(g)+Cl2(g)==="2HCl(g)" ΔH=-Q kJ·mol-1(Q>0),下列说法正确的是( )
| A.在一定条件下,1个氢气与1个氯气反应生成2个氯化氢放出Q kJ热量 |
| B.在一定条件下,1 mol氢气与1 mol氯气反应生成2 mol液态氯化氢放出Q kJ热量 |
| C.在相同条件下,1 mol氢气与1 mol氯气的能量总和大于2 mol氯化氢气体的能量 |
| D.在标准状况下,1L氢气和1 L氯气完全反应生成2L氯化氢气体放出QkJ热量 |
有机化合物A~H的转换关系如下所示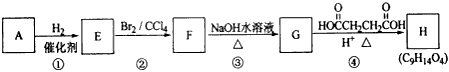
请回答下列问题
(1)链烃A有支链且只有一个官能团,其相对分子质量在65~75之间,1molA完全燃烧消耗7mol氧气,则A的结构简式是__________________,名称是__________________;
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E。由E转化为F的化学方程式是_______________________________;
(3)G与金属钠反应能放出气体,由F转化为G的化学方程式是__________________;
(4)①的反应类型是__________________;③的反应类型是__________________;
(5)链烃B是E的同分异构体,存在着顺反异构,其催化氢化产物为直链烷烃,写出B的结构简式_______________;
(6)C是A的一种同分异构体,它的一氯代物只有一种(不考虑立体异构,则C的结构简式__________________。
400K、1.01×105 Pa时,2 L烃A的蒸气能在m L氧气中完全燃烧,反应后体积增至(m+4)L(体积在同条件下测定。)
(1)烃A的组成上应满足的条件是 。
(2)当m=15时,该烃可能的分子式为 。
(3)若A在常温常压下为气态,m的取值范围是 。
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是(用离子方程式表示) 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,
c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3氧化FeCl2的离子方程式:
□ClO3―+□Fe2++□ =□Cl―+□Fe3++□ 。
(3)生成聚合氧化铁的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
电化学在化学工业有着广泛的应用,
(1)工业冶炼铝的化学方程式是 ;
(2)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换法膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
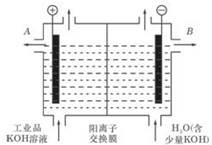
①该电解槽的阳极反应式是 ;
②除去杂质后的氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
(3)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O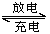 Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)
Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)
是一种新型净水剂.用下面装置可以制取少量高铁酸钠。
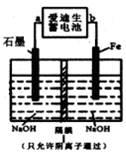
①此装置中爱迪生蓄电池的负极是________(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是 。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式 。
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH(固体) ②H2O ③HCl ④CH3COONa(固体)
| A.①② | B.②③ | C.③④ | D.②④ |
下列叙述正确的是
| A.100℃纯水在pH=6,所以水在100℃时呈酸性 |
| B.pH=3的盐酸溶液,稀释至10倍后pH>4 |
| C.0.2mol·L-1的醋酸与等体积水混合后pH=1 |
| D.pH=3的盐酸与pH=11的氢氧化钠等体积混合后pH=7 |
下列所用材料不属于合金的是
| A.家用的铝窗 | B.建筑用的钢筋 | C.铸造用的黄铜 | D.温度计用的水银 |
试题篮
()