为检验某溶液中的离子,下列操作方法及结论正确的是
| A.加入氯水,再加入KSCN溶液,溶液显红色,则溶液中一定含有Fe2+ |
| B.加入盐酸,产生无色无味且能使澄清石灰水变浑浊的气体,则溶液中一定含有CO32- |
| C.加入Ba(NO3)2溶液,再加入稀盐酸,产生白色沉淀,则溶液中一定含有SO42- |
| D.加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则溶液中一定含有NH4+ |
下列事实与胶体性质无关的是
| A.豆浆中加入CaSO4制豆腐 |
| B.清晨在茂密的森林里看到缕缕阳光穿过林木枝叶 |
| C.FeCl3溶液中加入NaOH溶液产生红褐色沉淀 |
| D.使用钢笔时不宜将不同品牌的墨水混用 |
实验室里需储存在棕色试剂瓶中的是
A.金属钠 B浓硝酸 C.FeSO4溶液 D.浓硫酸
苯甲酸(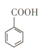 )和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率。据此某实验小组设计了如下图的装置来进行上述实验。相关信息如下:
)和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率。据此某实验小组设计了如下图的装置来进行上述实验。相关信息如下:
| |
相对分子质量 |
密度/(g·cm-3) |
沸点/℃ |
水中溶解度 |
| 苯甲酸 |
122 |
1.27 |
249 |
微溶 |
| 乙醇 |
46 |
0.789 |
78.3 |
易溶 |
| 苯甲酸乙酯 |
150 |
1.05 |
212.6 |
难溶 |
实验方案为:
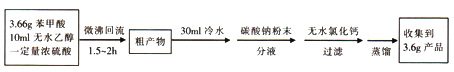

(1)仪器甲的名称为________________。
(2)①往丙中加入药品的顺序为_________________。
A.无水乙醇、浓硫酸、苯甲酸晶体 B.浓硫酸、苯甲酸晶体、无水乙醇
C.苯甲酸晶体、无水乙醇、浓硫酸 D.苯甲酸晶体、浓硫酸、无水乙醇
②若加热反应后发现未加沸石,应采取的正确操作是_____________。
③微沸回流过程中,可以看到乙内的混合试剂的颜色变为_______色。
(3)加入碳酸钠粉末的作用是__________________。
(4)分液要用到的玻璃仪器有__________,粗产物在_______层(填“上”或“下”)。
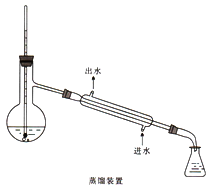
(5)加热蒸馏若采用下图装置(加热装置已经略去)进行,该装置存在的2个问题为__________、________。
(6)本实验所得到的苯甲酸乙酯产率为______________。
(7)装置乙的作用为____________________
Q、R、X、Y、Z是原子序数依次增大的前四周期元素,Q的一种单质是天然存在的最硬的物质,X原子的核外电子有八种运动状态,Y元素的离子半径是第三周期中最小的,Z是第四周期中未成对电子最多的原子。
(1)Z原子的价电子排布式为_________________。
(2)Q、R、X、Y四种元素的电负性由大到小的顺序是_______________。
(3)杂化轨道理论指出原子中能量相近的s、p或s、p、d轨道之间可以通过杂化形成种类丰富的杂化轨道。RCl3分子中心原子的杂化方式为___________,从原子结构的角度解释不存在RCl5分子的原因_______。
(4)配合物甲的分子式为ZCl3·4H2O,配位数为6。取1mol甲溶于水,加入足量的AgNO3溶液,得到143.5g白色沉淀。在酸性溶液中,甲发生水合反应转化为乙(ZCl3·6H2O)。乙的配位原子只有一种,配位数为6。
①甲的结构简式为_______________。
②甲→乙的化学方程式为______________。
(5)图a是Q的一种同素异形体和钾形成的插层化合物的晶胞图,图b是晶胞沿侧面的投影图。该插层化合物的化学式为______________。
Ⅰ.由苯乙烯制得的聚苯乙烯可用于制造一次性餐具。
(1)苯乙烯的分子式为_______________。
(2)苯乙烯制取聚苯乙烯的化学方程式为______________________。
Ⅱ.聚苯乙烯塑料性质稳定,会造成严重的“白色污染”。为此人们开发出一种聚乳酸塑料来替代聚苯乙烯。聚乳酸合成过程如下:
(3)淀粉和纤维素的分子式均可表示为(C6H10O5)n,下列关于淀粉和纤维素的说法正确的是( )
| A.互为同分异构体 | B.水解最终产物相同 |
| C.纤维素是纯净物 | D.均是高分子化合物 |
(4)乳酸分子中所含官能团有_________________(填名称)。
(5)根据结构推断聚乳酸可能发生的反应类型是______________,并据此说明用聚乳酸塑料替代聚苯乙烯塑料的好处是_____________。
(6)乳酸与足量Na反应的化学方程式为____________________。
a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物。b为EDTA与Ca2+形成的螯合物。下列叙述正确的是( )

A.a和b中的N原子均为sp3杂化
B.b中Ca2+的配位数为4
C.b含有分子内氢键
D.b含有共价键、离子键和配位键
PCl5和AlCl3形成的加合物PCl5·AlCl3由[PCl4]+和[AlCl4]-构成。下列有关该加合物的叙述正确的是( )
| A.属于分子晶体 | B.[PCl4]+空间构型为正四面体 |
| C.阴阳离子均含有配位键 | D.固态可导电 |
下表是A、B、C、D、E、F六种短周期元素的部分化合价、电负性和原子半径数据。下列说法正确的是( )
| |
A |
B |
C |
D |
E |
F |
| 化合价 |
+1 |
-2 |
-1 |
-2 |
-1 |
+1 |
| 电负性 |
2.1 |
2.5 |
3.0 |
3.5 |
4.0 |
0.9 |
| 原子半径/nm |
0.037 |
0.102 |
0.099 |
0.073 |
0.071 |
0.154 |
A.A的单质中含有金属键 B.F2D2含有非极性共价键
C.沸点:A2D<AE D.最高价氧化物对应水化物的酸性:B>C
乙烯通过一步反应不能制取的物质是( )
| A.CH3CH2OH | B.CH3CH2Cl | C.CH2BrCH2Br | D.CH2=CHCl |
徐光宪在《分子共和国》一书中介绍了许多明星分子,如H2O2、CO2、BF3、CH3COOH等。下列说法正确的是( )
| A.H2O2分子的空间构型为直线形 | B.CO2分子为非极性分子 |
| C.BF3分子中的B原子满足8电子稳定结构 | D.CH3COOH分子中C原子均为sp2杂化 |
在200mL0.5mol/L的氯化铝溶液中滴加0.5mol/L的氢氧化钠,得到3.9g的沉淀,求加入氢氧化钠的溶液的体积可能是多少?
海水提镁的工业流程如下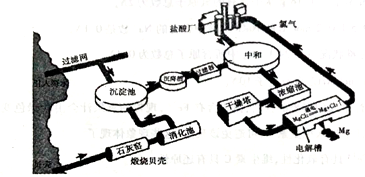
(1)煅烧贝壳时,贝壳的主要成分发生了什么变化?__________(用化学方程式表示)。
(2)从海水中的镁离子到金属镁,主要经历了三步化学变化,写出前两步反应的化学反应方程式:
①______________;②_______________。
③第三步反应(MgCl2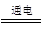 Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是____________。
Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是____________。
(3)在生产过程中采用了一些措施提高经济效益,请写出一点____________________。
(4)输送氯气的管道需要定期检查是否漏气,管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应(在有水蒸气存在的条件下):2NH3+3Cl2=N2+6HCl。下列说法中正确的是__________。
A.用该方法检验管道泄漏处会产生白烟
B.管道泄漏处会闻到刺激性气味
C.该反应中的HCl是氧化产物,N2是还原产物
盛放NaOH溶液的试剂瓶不能用玻璃塞,是为了防止发生反应(用离子方程式表示)________,避免瓶口与瓶塞粘在一起。
制造普通玻璃的主要原料是(写名称)_________、________、__________。
试题篮
()