短周期中的主族元素M、R(M、R代表元素符号)形成的简单离子M2-与R+的核外电子数之和为20,下列说法中,正确的是
| A.M原子所含质子数一定大于R原子所含质子数 |
| B.M、R两种元素结合形成的化合物中不可能含有共价键 |
| C.M2-与R+的电子层结构不可能相同 |
| D.M一定存在同素异形体 |
【改编】将等物质的量的A、B混合于1L的密闭容器中,发生反应:A(g)+ 3B(g) 2C(g)+ xD(g),经2min后,测得D的浓度为0.4mol/L,c(A):c(B)=" 5:" 3,C的平均反应速率是0.1 mol/(L·min)。求:
2C(g)+ xD(g),经2min后,测得D的浓度为0.4mol/L,c(A):c(B)=" 5:" 3,C的平均反应速率是0.1 mol/(L·min)。求:
(1)此时A的浓度及反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值
某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,…,关闭活塞a。
请回答:
(1)B中反应的离子方程式是__ ____。
(2)通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
| A.挥发性 | B.还原性 | C.氧化性 | D.酸性 |
(3)C装置的作用是________,X是________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是______ __,
D中反应的化学方程式是_____ ___。
(5)碳、硅的非金属性逐渐减弱的原因是________(从原子结构角度加以解释)。
【原创】现有A、B、C、D、E五种金属片,①把A、C用导线连接后同时浸入稀硫酸铜溶液中,A上有红色固体产生;②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生氧化反应;③把A、B用导线连接后同时浸入稀硫酸溶液中,电流方向为B→导线→A;④将E放入水中,立即有气体产生。根据上述情况,回答下列问题:
(1)在①中,金属片_______发生氧化反应;
(2)在②中,金属片_______作负极;
(3)如果把B、D用导线连接后同时浸入稀硫酸溶液,则金属片_______上有气泡产生;
(4)上述五种金属的活动性顺序是__________________。
如图所示是Zn和Cu形成的原电池,其实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
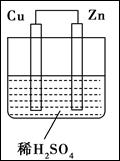

| A.①②③ | B.②④ | C.④⑤⑥ | D.③④⑤ |
将铁片和碳棒按下图所示方式插入硫酸铜溶液中,电流计指针发生偏转。下列针对该装罝的说法,正确的是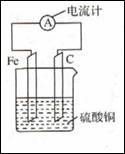
| A.碳棒是正极 |
| B.该装置能将电能转化为化学能 |
| C.外电路中电流由铁片流出经过电流计流向碳棒 |
| D.该装置的总反应为:2Fe+3Cu2+=2Fe3++3Cu |
下表是部分短周期元素的原子半径及主要化合价,以下叙述正确的是
| A.气态氢化物的稳定性为H2T<H2R |
| B.单质与稀盐酸反应的速率为L<Q |
| C.M与T形成的化合物具有两性 |
| D.L2+与R2-的核外电子数相等 |
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是
| A.Y的气态简单氢化物的热稳定性比W的强 |
| B.X的最高价氧化物对应水化物的酸性比W的弱 |
| C.Y分别与Z、W形成的化合物均为碱性氧化物 |
| D.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
【改编】短周期的两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n。下列说法错误的是
| A.若m=2,则X必定为第ⅡA元素 |
| B.若a=m,则有两种金属元素 |
| C.若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为非极性分子 |
| D.若a=b=3,8>m>n>b,则元素非金属性:X>Y |
【原创】在一定温度的密闭容器中将氨气充入容器中,进行如下的反应:2NH3 N2+3H2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NH3)=0.6 mol/L,c(N2)=0.2 mol/L。试求:
N2+3H2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NH3)=0.6 mol/L,c(N2)=0.2 mol/L。试求:
(1)氨气的转化率为多少?
(2)反应前后的压强比为多少?
(3)计算该温度下氮气的体积分数.
(4)在这5分钟内,用N2来表示的平均反应速率是多少?
(5)平衡时氢气的浓度是多少?
选做【化学——有机化学】1-对甲苯基-3-苯基-2-丙烯-1-酮(以下用M表示)是一种常见的工业原料,其结构简式为: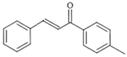 ,工业上合成M线路如下(反应中生成的小分子已略去):
,工业上合成M线路如下(反应中生成的小分子已略去):
已知:在稀碱作用下,两分子的醛或酮可以互相作用,其中一个醛(或酮)分子中的α-氢加到另一个醛(或酮)分子的羰基氧原子上,其余部分加到羰基碳原子上,生成一分子β-羟基醛或一分子β-羟基酮。
请回答下列问题:
(1)有机物B的名称为 。
(2)物质A、C的关系为 。
a.同系物 b.同分异构体
c.同素异形体 d.分子式相差1个CH2
(3)①~④反应中,属于加成反应的有 。
(4)反应②的化学方程式为 。
(5) 的同分异构体有许多。能与NaHCO3反应,且含有联苯基(
的同分异构体有许多。能与NaHCO3反应,且含有联苯基( 上1个氢原子被取代)的同分异构体共有 种。
上1个氢原子被取代)的同分异构体共有 种。
选做【化学——物质的结构】在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物。氢化物晶体的结构有共价型和离子型之分。
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac+ CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①请写出基态Cu原子的电子排布式 。
②氨水溶液中各元素原子的电负性从大到小排列顺序为 。
③醋酸分子中的两个碳原子,甲基(—CH3)碳和羧基(—COOH)碳的杂化方式分别是 。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有 。
a.离子键 b.配位键 c.σ键 d.π键
(2)某离子型氢化物化学式为XY2,晶胞结构如下图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞 。(填“侧面”或“内部”)
②XY2晶体、硅烷晶体和固态氨3种氢化物熔沸点高低顺序正确的是 。
a.XY2晶体>硅烷晶体>固态氨 b.XY2晶体>固态氨>硅烷晶体
c.固态氨>硅烷晶体>XY2晶体 d.硅烷晶体>固态氨>XY2晶体
选做【化学——化学与技术】煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(1)煤的气化和液化可以提高煤的利用率。煤的气化技术的主要产物是 。煤的液化技术又分为直接液化和间接氧化。将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为 。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放。
①在燃烧前,可以采用微生物脱硫技术。原理如下:
上述过程中Fe2+的作用为 。写出Fe2+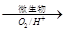 Fe3+的离子方程式 。
Fe3+的离子方程式 。
②煤在燃烧时,进行脱硫处理,常采用 燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用。常用脱硫剂的主要化学成分为 (填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术。湿法脱硫、脱硝技术中将烟气通入 设备,用石灰水淋洗。
工厂中用稀硫酸浸泡某矿石后的溶液中,除了含有大量硫酸外,还含有少量NH4+、Fe3+、AsO43-、Cl-。为除去杂质离子,部分操作流程如下:
请回答问题:
(1)用稀硫酸浸泡某矿石后的溶液中,硫酸的浓度为4.9g·L-1,则该溶液中的pH约为 。
(2)NH4+在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在。现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(NH4+)恰好是NH4Cl溶液中c(NH4+)的2倍,则c[(NH4)2SO4] c(NH4Cl)(填:<、=或>)。
(3)随着向废液中投入生石灰(忽略溶液温度的变化),溶液中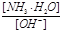 _______(填“增大”、“减小”或“不变”)。
_______(填“增大”、“减小”或“不变”)。
(4)投入生石灰调节pH到2~3时,大量沉淀主要成分为CaSO4·2H2O[含有少量Fe(OH)3],提纯CaSO4·2H2O的主要操作步骤:向沉淀中加入过量 ,充分反应后,过滤、洗涤、 。
(5)25℃, H3AsO4电离常数为K1=5.6×10-3,K2=1.7×10-7,K3=4.0×10-12。当溶液中pH调节到8~9时,沉淀主要成分为Ca3(AsO4)2。
①pH调节到8左右Ca3(AsO4)2才开始沉淀的原因是 。
②Na3AsO4第一步水解的平衡常数数值为: 。
③已知:AsO43-+2I-+2H+= AsO33-+I2+H2O ,SO2+I2+2H2O=SO42-+2I-+4H+ 。上述两个反应中还原性最强的微粒是 。
ToC时,在一固定容积的密闭容器中发生反应:A(g)+B(g) C(s) ∆H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s) ∆H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
A.ToC时,该反应的平衡常数值为4
B.c点没有达到平衡,此时反应向逆向进行
C.若c点为平衡点,则此时容器内的温度高于ToC
D.ToC时,直线cd上的点均为平衡状态
试题篮
()