室温下可见光催化合成技术,对于人工模仿自然界、发展有机合成新方法意义重大。一种基于 CO、碘代烃类等,合成化合物ⅶ的路线如下(加料顺序、反应条件略):
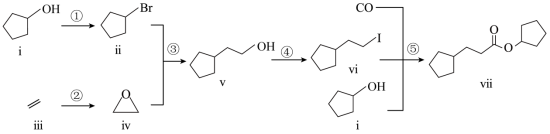
(1)化合物i的分子式为___________。化合物x为i的同分异构体,且在核磁共振氢谱上只有2组峰。x的结构简式为___________(写一种),其名称为___________。
(2)反应②中,化合物ⅲ与无色无味气体y反应,生成化合物ⅳ,原子利用率为 100%。y为___________。
(3)根据化合物V的结构特征,分析预测其可能的化学性质,完成下表。
|
序号 |
反应试剂、条件 |
反应形成的新结构 |
反应类型 |
|
a |
___________ |
___________ |
消去反应 |
|
b |
___________ |
___________ |
氧化反应(生成有机产物) |
(4)关于反应⑤的说法中,不正确的有___________。
A. 反应过程中,有 C-I键和 H-O键断裂
B. 反应过程中,有 C=O双键和 C-O单键形成
C. 反应物i中,氧原子采取 sp3杂化,并且存在手性碳原子
D. CO属于极性分子,分子中存在由p轨道“头碰头”形成的 π键
(5)以苯、乙烯和 CO为含碳原料,利用反应③和⑤的原理,合成化合物ⅷ。
基于你设计的合成路线,回答下列问题:
(a)最后一步反应中,有机反应物为___________(写结构简式)。
(b)相关步骤涉及到烯烃制醇反应,其化学方程式为___________。
(c)从苯出发,第一步的化学方程式为___________(注明反应条件)。
配合物广泛存在于自然界,且在生产和生活中都发挥着重要作用。
(1)某有机物 R能与 Fe2+形成橙红色的配离子 [FeR3]2+,该配离子可被 HNO3氧化成淡蓝色的配离子 [FeR3]3+。
①基态 Fe2+的 3d电子轨道表示式为___________。
②完成反应的离子方程式: NO-3+2[FeR3]2++3H+⇌______ +2[FeR3]3++H2O
(2)某研究小组对(1)中②的反应进行了研究。
用浓度分别为 2.0mol⋅L-1、2.5mol⋅L-1、3.0mol⋅L-1的 HNO3溶液进行了三组实验,得到 c([FeR3]2+)随时间t的变化曲线如图。
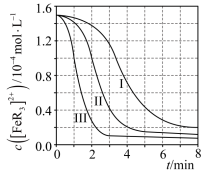
① c(HNO3)=3.0 mol⋅L-1时,在 0~1 min内, [FeR3]2+的平均消耗速率=___________。
②下列有关说法中,正确的有___________。
A.平衡后加水稀释, c([FeR3]2+)c([FeR3]3+)增大
B. [FeR3]2+平衡转化率: αIII>αII>αI
C.三组实验中,反应速率都随反应进程一直减小
D.体系由橙红色转变为淡蓝色所需时间: tIII>tII>tI
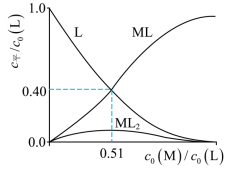
(3)R的衍生物L可用于分离稀土。溶液中某稀土离子(用M表示)与L存在平衡:
M+L⇌ML K1
ML+L⇌ML2 K2
研究组配制了L起始浓度 c0( L)=0.02 mol⋅L-1、M与L起始浓度比 c0(M)/c0(L)不同的系列溶液,反应平衡后测定其核磁共振氢谱。配体L上的某个特征H在三个物种 L、ML、ML2中的化学位移不同,该特征H对应吸收峰的相对峰面积S(体系中所有特征H的总峰面积计为1)如下表。
|
c0(M)/c0(L) |
S(L) |
S(ML) |
S(ML2) |
|
0 |
1.00 |
0 |
0 |
|
a |
x |
<0.01 |
0.64 |
|
b |
<0.01 |
0.40 |
0.60 |
【注】核磁共振氢谱中相对峰面积S之比等于吸收峰对应H的原子数目之比;“ <0.01”表示未检测到。
① c0(M)/c0(L)=a时, x= ___________。
② c0(M)/c0(L)=b时,平衡浓度比 c平(ML2):c平(ML)=___________。
(4)研究组用吸收光谱法研究了(3)中M与L反应体系。当 c0(L)=1.0×10-5mol⋅L-1时,测得平衡时各物种 c平/c0(L)随 c0(M)/c0(L)的变化曲线如图。 c0(M)/c0(L)=0.51时,计算M的平衡转化率(写出计算过程,结果保留两位有效数字)。
Ni、Co均是重要的战略性金属。从处理后的矿石硝酸浸取液(含 Ni2+、Co2+、Al3+、Mg2+)中,利用氨浸工艺可提取 Ni、Co,并获得高附加值化工产品。工艺流程如下:
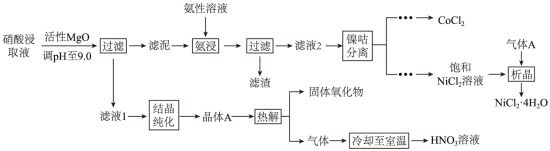
已知:氨性溶液由 NH3⋅H2O、 (NH4)2SO3和 (NH4)2CO3配制。常温下, Ni2+、Co2+、Co3+与 NH3形成可溶于水的配离子: lgKb(NH3⋅H2O)=-4.7; Co(OH)2易被空气氧化为 Co(OH)3;部分氢氧化物的 Ksp如下表。
|
氢氧化物 |
Co(OH)2 |
Co(OH)3 |
Ni(OH)2 |
Al(OH)3 |
Mg(OH)2 |
|
Ksp |
5.9×10-15 |
1.6×10-44 |
5.5×10-16 |
1.3×10-33 |
5.6×10-12 |
回答下列问题:
(1)活性 MgO可与水反应,化学方程式为___________。
(2)常温下, pH=9.9的氨性溶液中, c(NH3⋅H2O)___________ c(NH+4) (填“>”“<”或“=”)。
(3)“氨浸”时,由 Co(OH)3转化为 [Co(NH3)6]2+的离子方程式为___________。
(4) (NH4)2CO3会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了 NH4Al(OH)2CO3的明锐衍射峰。
① NH4Al(OH)2CO3属于___________(填“晶体”或“非晶体”)。
② (NH4)2CO3提高了 Ni、Co的浸取速率,其原因是___________。
(5)①“析晶”过程中通入的酸性气体A为___________。
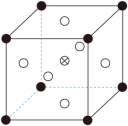
②由 CoCl2可制备 AlxCoOy晶体,其立方晶胞如图。 Al与O最小间距大于 Co与O最小间距,x、y为整数,则 Co在晶胞中的位置为___________;晶体中一个 Al周围与其最近的O的个数为___________。
(6)①“结晶纯化”过程中,没有引入新物质。晶体A含6个结晶水,则所得 HNO3溶液中 n(HNO3)与 n(H2O)的比值,理论上最高为___________。
②“热解”对于从矿石提取 Ni、Co工艺的意义,在于可重复利用 HNO3和___________(填化学式)。
化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式 Q=cρV总⋅ΔT计算获得。
(1)盐酸浓度的测定:移取 20.00 mL待测液,加入指示剂,用 0.5000 mol⋅L-1NaOH溶液滴定至终点,消耗 NaOH溶液 22.00 mL。
①上述滴定操作用到的仪器有___________。
| A. |
|
B. |
|
C. |
|
D. |
|
②该盐酸浓度为___________ mol⋅L-1。
(2)热量的测定:取上述 NaOH溶液和盐酸各 50 mL进行反应,测得反应前后体系的温度值( °C)分别为 T0、T1,则该过程放出的热量为___________ J(c和 ρ分别取 4.18 J⋅g-1⋅°C-1和 1.0 g⋅mL-1,忽略水以外各物质吸收的热量,下同)。
(3)借鉴(2)的方法,甲同学测量放热反应 Fe(s)+CuSO4(aq)=FeSO4(aq)+Cu(s)的焓变 ΔH(忽略温度对焓变的影响,下同)。实验结果见下表。
|
序号 |
反应试剂 |
体系温度/ °C |
||
|
反应前 |
反应后 |
|||
|
i |
0.20 mol⋅L-1CuSO4溶液 100 mL |
1.20 g Fe粉 |
a |
b |
|
ii |
0.56 g Fe粉 |
a |
c |
|
①温度:b___________c(填“>”“<”或“=”)。
② ΔH=___________(选择表中一组数据计算)。结果表明,该方法可行。
(4)乙同学也借鉴(2)的方法,测量反应 A:Fe(s)+Fe2(SO4)3(aq)=3FeSO4(aq)的焓变。
查阅资料:配制 Fe2(SO4)3溶液时需加入酸。加酸的目的是___________。
提出猜想: Fe粉与 Fe2(SO4)3溶液混合,在反应A进行的过程中,可能存在 Fe粉和酸的反应。
验证猜想:用 pH试纸测得 Fe2(SO4)3溶液的 pH不大于1;向少量 Fe2(SO4)3溶液中加入 Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和___________(用离子方程式表示)。
实验小结:猜想成立,不能直接测反应A的焓变。
教师指导:鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
优化设计:乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为___________。
(5)化学能可转化为热能,写出其在生产或生活中的一种应用___________。
丙烯腈(CH 2=CHCN)是一种重要的化工原料,工业上可用"丙烯氨氧化法"生产.主要副产物有丙烯醛(CH 2=CHCHO)和乙腈(CH 3CN)等。回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C 3H 3N)和副产物丙烯醛(C 3H 4O)。热化学方程式如下:①C 3H 6(g)+NH 3(g)+ 32 O 2(g)═C 3H 3N(g)+3H 2O(g)△H=﹣515kJ•mol ﹣ 1
②C 3H 6(g)+O 2(g)═C 3H 4O(g)+H 2O(g)△H=﹣353kJ•mol ﹣ 1
两个反应在热力学上趋势均很大,其原因是________;有利于提高丙烯腈平衡产率的反应条件是________;提高丙烯腈反应选择性的关键因素是________.
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃.低于460℃时,丙烯腈的产率________(填"是"或"不是")对应温度下的平衡转化率,判断理由是________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号).

| A. |
催化剂活性降低 |
B. |
平衡常数变大 |
| C. |
副反应增多 |
D. |
反应活化能增大 |
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示.由图可知,最佳n(氨)/n(丙烯)约为________,理由是________.进料气氨、空气、丙烯的理论体积比约为________.
联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为________,其中氮的化合价为________.
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为________.
(3)①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=﹣1048.9kJ•mol﹣1
上述反应热效应之间的关系式为△H4=________,联氨和N2O4可作为火箭推进剂的主要原因为________.
(4) 联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离反应的平衡常数值为________(已知:N2H4+H+⇌N2H5+的K=8.7×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为________.
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是________.联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1kg的联氨可除去水中溶解的O2________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是________.
[化学--选修3:物质结构与性质]
在普通铝中加入少量 Cu 和 Mg 后,形成一种称为拉维斯相的 MgCu2 微小晶粒,其分散在 Al 中可使得铝材的硬度增加、延展性减小,形成所谓"坚铝",是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是(填标号)。
A. [Ne]eqoac(○,↑)3s B. [Ne]eqoac(○,↑)eqoac(○,↓)3s C. [Ne]eqoac(○,↑)3seqoac(○,↑)3p D. [Ne]eqoac(○,↑)3p
(2)乙二胺 (H2NCH2CH2NH2) 是一种有机化合物,分子中氮、碳的杂化类型分别是 、 。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是,其中与乙二胺形成的化合物稳定性相对较高的是(填" Mg2+ "或" Cu2+ ")。
(3)一些氧化物的熔点如下表所示:
| 氧化物 |
Li2O |
MgO |
P4O6 |
SO2 |
| 熔点/°C |
1570 |
2800 |
23.8 |
-75.5 |
解释表中氧化物之间熔点差异的原因 。
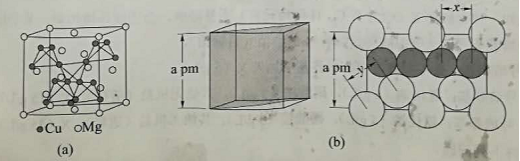
(4)图(a)是 MgCu2 的拉维斯结构, Mg 以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的 Cu 。图(b)是沿立方格子对角面取得的截图。可见, Cu 原子之间最短距离 x= pm , Mg 原子之间最短距离 y= pm 。设阿伏加德罗常数的值为 NA ,则 MgCu2 的密度是 g·cm-3 (列出计算表达式)。
[化学一一选修3: 物质结构与性质]
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1) 基态 Ge 原子的核外电子排布式为[Ar] ,有 个末成对电子。
(2) Ge 与 C 是同族元素, C 原子之间可以形成双键、叁键, 但 Ge 原子之间难以形成双键或 叁键。从原子结构角度分析,原因是 。
(3)比较下列锗卤化物的熔点和沸点, 分析其变化规律及原因 。
GeCl4 |
GeBr4 |
Gel4 |
|
熔点/ ∘C |
-49.5 |
26 |
146 |
沸点/ ∘C |
83.1 |
186 |
约 400 |
(4) 光催化还原 CO2 制备 CH4 反应中,带状纳米 Zn2GeO4 是该反应的良好催化剂。 Zn 、Ge、O 电负性由大至小的顺序是 。
(5) Ge 单晶具有金刚石型结构, 其中 Ge 原子的杂化方式为_ , 微粒之间存在的作用力是_ 。
(6)晶胞有两个基本要素:
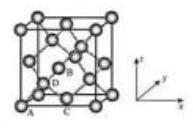
①原子坐标参数, 表示晶胞内部各原子的相对位置, 下图为 Ge 单晶的晶胞, 其中原子坐标参数 A 为 (0,0,0);B 为 (12,0,12);C 为 (12,12,0) 。则 D 原子的坐标参数为 。
②晶胞参数, 描述晶胞的大小和形状,已知 Ge 单晶的晶胞参数 a=565.76pm, 其密度为 g⋅cm-3 (列出计算式即可)。
【化学ーー选修2:化学与技术】
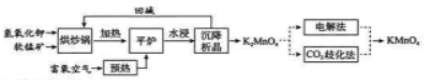
高锰酸钾( KMnO4 )是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为 MnO2 )为原料生产高锰酸钾的工艺路线如下:
回答下列问题:
(1) 原料软锰矿与氢氧化钾按 1 :1 的比例在 "烘炒锅"中混配,混配前应将软锰矿粉碎, 其作用是 。
(2) "平炉"中发生的化学方程式为 .
(3)"平炉"中需要加压,其目的是 。
(4) 将 K2MnO4 转化为 KMnO4 的生产有两种工艺。
① "CO2 歧化法" 是传统工艺, 即在 K2MnO4 溶液中通入 CO2 气体, 使体系呈中性或弱碱性,
K2MnO4 发生歧化反应,反应中生成 K2MnO4,MnO2 和 (写化学式)。
② "电解法" 为现代工艺, 即电解 K2MnO4 水溶液, 电解槽中阳极发生的电极反应为 , 阴极逸出的气体是_ 。
③ "电解法" 和 "CO2 歧化法" 中, K2MnO4 的理论利用率之比为 _ 。
(5)高锰酸钾纯度的测定:称取 1.0800g 样品, 溶解后定容于 100mL 容量瓶中, 摇匀。取浓度为 0.2000mol⋅L-1 的 H2C2O4 标准溶液 20.00mL , 加入稀硫酸酸化,用 KMnO4 溶液平行滴定三次, 平均消耗的体积为 24.48mL , 该样品的纯度为 。
(列出计算式即可, 已知 2MnO-4+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O ) 。
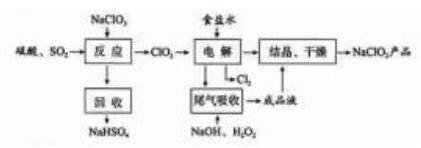
NaClO2 是一种重要的杀菌消毒剂, 也常用来漂白织物等, 其一种生产工艺如下:
回答下列问题:
(1) NaClO2 中 Cl 的化合价为_ 。
(2) 写出 "反应"步骤中生成 ClO2 的化学方程式 。
(3) "电解"所用食盐水由粗盐水精制而成, 精制时,为除去 Mg2+ 和 Ca2+ , 要加入的试剂分别为 、 。"电解" 中阴极反应的主要产物是_ 。
(4) "尾气吸收"是吸收 "电解"过程排出的少量 ClO2 。此吸收反应中, 氧化剂与还原剂的
物质的量之比为 ,该反应中氧化产物 。
(5)"有效氯含量"可用来衡量含氯消毒剂的消毒能力, 其定义是:每克含氯消毒剂的氧化
能力相当于多少克 Cl2 的氧化能力。 NaClO2 的有效氯含量为 。(计算结果保留两位小数)
磁选后的炼铁高钛炉渣,主要成分有 TiO2 、 SiO2 、 Al2O3 、 MgO 、 CaO 以及少量的 Fe2O3 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
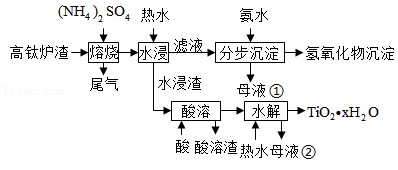
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
| 金属离子 |
Fe3+ |
Al3+ |
Mg2+ |
Ca2+ |
| 开始沉淀的pH |
2.2 |
3.5 |
9.5 |
12.4 |
| 沉淀完全 (c=1.0×10﹣5molL﹣1) 的pH |
3.2 |
4.7 |
11.1 |
13.8 |
回答下列问题:
(1)"焙烧"中, TiO2 、 SiO2 几乎不发生反应, Al2O3 、 MgO 、 CaO 、 Fe2O3 转化为相应的硫酸盐。写出 Al2O3 转化为 NH4Al(SO4)2 的化学方程式 。
(2)"水浸"后"滤液"的 pH 约为2.0,在"分步沉淀"时用氨水逐步调节 pH 至11.6,依次析出的金属离子是 。
(3)"母液①"中 Mg2+ 浓度为 mol•L﹣1 。
(4)"水浸渣"在 160℃ "酸溶",最适合的酸是 。"酸溶渣"的成分是 、 。
(5)"酸溶"后,将溶液适当稀释并加热, TiO2+ 水解析出 TiO2xH2O 沉淀,该反应的离子方程式是 。
(6)将"母液①"和"母液②"混合,吸收尾气,经处理得 ,循环利用。
胆矾( CuSO4⋅5H2O )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 CuO (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有________(填标号)。
| A. |
烧杯 |
B. |
容量瓶 |
C. |
蒸发皿 |
D. |
移液管 |
(2)将 CuO 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为___________,与直接用废铜和浓硫酸反应相比,该方法的优点是_________。
(3)待 CuO 完全反应后停止加热,边搅拌边加入适量 H2O2 ,冷却后用 NH3⋅H2O 调 pH 为3.5~4,再煮沸 10min ,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、________、乙醇洗涤、________,得到胆矾。其中,控制溶液 pH 为3.5~4的目的是_________,煮沸 10min 的作用是_________。
(4)结晶水测定:称量干燥坩埚的质量为 m1 ,加入胆矾后总质量为 m2 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为 m3 。根据实验数据,胆矾分子中结晶水的个数为_________(写表达式)。
(5)下列操作中,会导致结晶水数目测定值偏高的是________(填标号)。
| A. |
①胆矾未充分干燥 |
| B. |
②坩埚未置于干燥器中冷却 |
| C. |
③加热时有少胆矾迸溅出来 |
碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1) I2 的一种制备方法如下图所示:
净化除氯后含I海水 →AgNO3↓富集 →悬浊液 →↓沉淀Fe粉↓转化 →Cl2↓氧化 →I2
①加入 Fe 粉进行转化反应的离子方程式为_________,生成的沉淀与硝酸反应,生成________后可循环使用。
②通入 Cl2 的过程中,若氧化产物只有一种,反应的化学方程式为__________;若反应物用量比 n(Cl2)/n(FeI2)=1.5 时,氧化产物为_________;当 n(Cl2)/n(FeI2)>1.5 ,单质碘的收率会降低,原因是___________。
(2)以 NaIO3 为原料制备 I2 的方法是:先向 NaIO3 溶液中加入计量的 NaHSO3 ,生成碘化物;再向混合溶液中加入 NaIO3 溶液,反应得到 I2 ,上述制备 I2 的总反应的离子方程式为__________。
(3) KI 溶液和 CuSO4 溶液混合可生成 CuI 沉淀和 I2 ,若生成 1molI2 ,消耗的 KI 至少为_______ mol 。 I2 在 KI 溶液中可发生反应: I2+I- 。实验室中使用过量的 与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是________。
化合物F是合成吲哚﹣2﹣酮类药物的一种中间体,其合成路线如图:
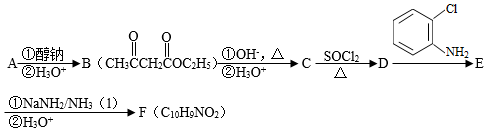
已知:Ⅰ.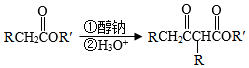
Ⅱ.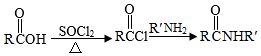
Ⅲ.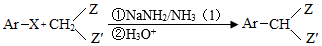
Ar为芳基;X=Cl,Br;Z或Z′=COR,CONHR,COOR等。
回答下列问题:
(1 )实验室制备A的化学方程式为 ,提高A产率的方法是 ; A的某同分异构体只有一种化学环境的碳原子,其结构简式为 。
(2)C→D的反应类型为 ; E中含氧官能团的名称为 。
(3)C的结构简式为 ,F的结构简式为 。
(4)Br2和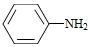 的反应与Br2和苯酚的反应类似,以
的反应与Br2和苯酚的反应类似,以 和
和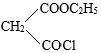 为原料合成
为原料合成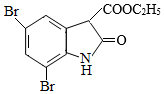 ,写出能获得更多目标产物的较优合成路线(其它试剂任选)。
,写出能获得更多目标产物的较优合成路线(其它试剂任选)。
探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=﹣49.5 kJ•mol﹣1
Ⅱ.CO(g)+2H2(g)⇌CH3OH(g)△H2=﹣90.4 kJ•mol﹣1
Ⅲ.CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3
回答下列问题:
(1)△H3= kJ•mol﹣1。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1mol CO2和3mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为bmol,此时H2O(g)的浓度为 mol•L﹣1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为 。
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。
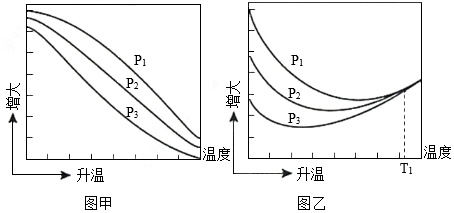
已知:CO2的平衡转化率 100%
CH3OH的平衡产率 100%
其中纵坐标表示CO2平衡转化率的是图 (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为 ;图乙中T1温度时,三条曲线几乎交于一点的原因是 。
(4 )为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为 (填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
试题篮
()