碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1) 的一种制备方法如下图所示:
①加入 粉进行转化反应的离子方程式为_________,生成的沉淀与硝酸反应,生成________后可循环使用。
②通入 的过程中,若氧化产物只有一种,反应的化学方程式为__________;若反应物用量比 时,氧化产物为_________;当 ,单质碘的收率会降低,原因是___________。
(2)以 为原料制备 的方法是:先向 溶液中加入计量的 ,生成碘化物;再向混合溶液中加入 溶液,反应得到 ,上述制备 的总反应的离子方程式为__________。
(3) 溶液和 溶液混合可生成 沉淀和 ,若生成 ,消耗的 至少为_______ 。 在 溶液中可发生反应: 。实验室中使用过量的 与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是________。
用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3 )和BaS制备高纯MnCO3的工艺流程如图:
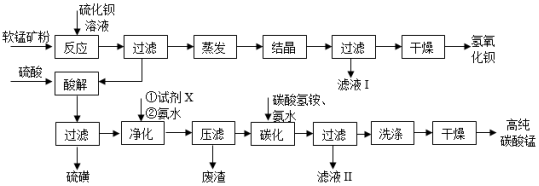
已知:MnO2是一种两性氧化物; 25℃时相关物质的Ksp见下表。
物质 |
Fe(OH)2 |
Fe(OH)3 |
Al(OH)3 |
Mn(OH)2 |
Ksp |
1×10﹣16.3 |
1×10﹣38.6 |
1×10﹣32.3 |
1×10﹣12.7 |
回答下列问题:
(1)软锰矿预先粉碎的目的是 ,MnO2 与BaS溶液反应转化为MnO的化学方程式为 。
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是 。
(3)滤液Ⅰ可循环使用,应当将其导入到 操作中 (填操作单元的名称)。
(4)净化时需先加入的试剂X为 (填化学式),再使用氨水调溶液的pH,则pH的理论最小值为 (当溶液中某离子浓度c≤1.0×10﹣5mol•L﹣1时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为 。
钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO 2、Fe 3O 4。采用如图工艺流程可由黏土钒矿制备NH 4VO 3。
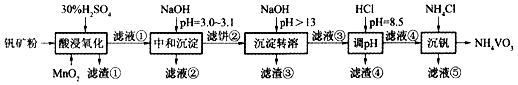
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示。
| 金属离子 |
Fe 3+ |
Fe 2+ |
Al 3+ |
Mn 2+ |
| 开始沉淀pH |
1.9 |
7.0 |
3.0 |
8.1 |
| 完全沉淀pH |
3.2 |
9.0 |
4.7 |
10.1 |
回答下列问题:
(1)"酸浸氧化"需要加热,其原因是 。
(2)"酸浸氧化"中,VO +和VO 2+被氧化成VO 2 +,同时还有 离子被氧化。写出VO +转化为VO 2 +反应的离子方程式 。
(3)"中和沉淀"中,钒水解并沉淀为V 2O 5•xH 2O,随滤液②可除去金属离子K +、Mg 2+、Na +、 ,以及部分的 。
(4)"沉淀转溶"中,V 2O 5•xH 2O转化为钒酸盐溶解。滤渣③的主要成分是 。
(5)"调pH"中有沉淀生产,生成沉淀反应的化学方程式是 。
吸收工厂烟气中的SO2,能有效减少SO2对空气的污染。氨水、ZnO水悬浊液吸收烟气中SO2后经O2催化氧化,可得到硫酸盐。
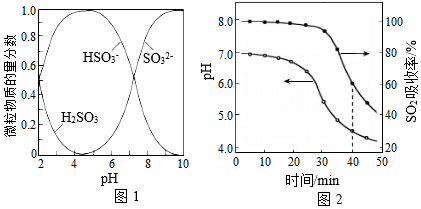
已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、HSO3﹣、SO32﹣的物质的量分数随pH的分布如图1所示。
(1)氨水吸收SO2.向氨水中通入少量SO2,主要反应的离子方程式为 ;当通入SO2至溶液pH=6时,溶液中浓度最大的阴离子是 (填化学式)。
(2)ZnO水悬浊液吸收SO2.向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(如图2)。溶液pH几乎不变阶段,主要产物是 ( 填化学式);SO2吸收率迅速降低阶段,主要反应的离子方程式为 。
(3)O2催化氧化。其他条件相同时,调节吸收SO2得到溶液的pH在4.5~6.5范围内,pH越低SO42﹣生成速率越大,其主要原因是 ;随着氧化的进行,溶液的pH将 (填“增大”、“减小”或“不变“)。
作为一种绿色消毒剂,H2O2在公共卫生事业中发挥了重要的作用。已知反应:H2O2(l)═H2O(1) O2(g)△H=﹣98 kJ•mol﹣1 K=2.88×1020回答问题:
(1)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是 。
(2)纯H2O2可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2剧烈分解:H2O2(l)═H2O(g) O2(g),放出大量气体,驱动火箭升空。每消耗34g H2O2,理论上 (填“放出”或“吸收”)热量 98kJ (填“大于”、“小于”或“等于”)。
(3)纯H2O2相对稳定,实验表明在54℃下恒温贮存2周,浓度仍能保持99%,原因是H2O2分解反应的 (填编号)。
a.△H比较小
b.K不够大
c.速率比较小
d.活化能比较大
(4)向H2O2稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起 作用。某组实验数据如下表:
t/min |
0 |
10 |
20 |
30 |
40 |
50 |
c(H2O2)/mol•L﹣1 |
0.70 |
0.49 |
0.35 |
0.25 |
0.17 |
0.12 |
0~30 min H2O2反应的平均速率v= mol•L•min﹣1
(5)H2O2 的一种衍生物K2S2O8,阴离子结构式为(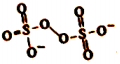 )。其中性溶液加热至沸后,溶液pH降低,用离子方程式表明原因: 。
)。其中性溶液加热至沸后,溶液pH降低,用离子方程式表明原因: 。
试题篮
()