【选修五:有机化学基础】
环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂G的合成路线:

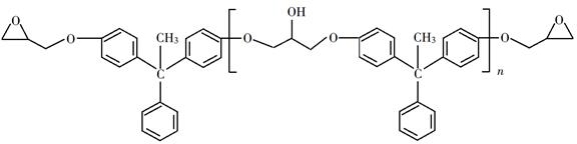
已知以下信息:

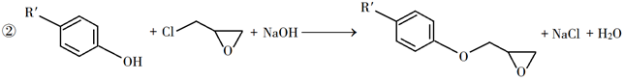
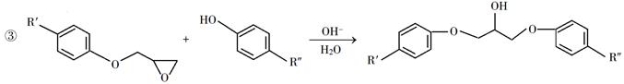
回答下列问题:
(1)A是一种烯烃,化学名称为________,C中官能团的名称为________、________。
(2)由B生成C的反应类型为________。
(3)由C生成D的反应方程式为________。
(4)E的结构简式为________。
(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式________、________。
①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1。
(6)假设化合物D、F和NaOH恰好完全反应生成1 mol单一聚合度的G,若生成的NaCl和H 2O的总质量为765g,则G的 n值理论上应等于________。
立德粉
ZnS·BaSO4 (也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。
| A. | 黄色 |
| B. | 红色 |
| C. | 紫色 |
| D. | 绿色 |
(2)以重晶石( BaSO4 )为原料,可按如下工艺生产立德粉:
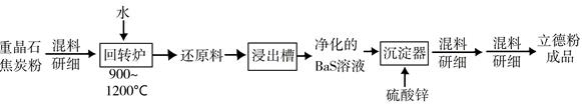
①在回转窑中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为________。回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为 CO2 和一种清洁能源气体,该反应的化学方程式为________。
②在潮湿空气中长期放置的"还原料",会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是"还原料"表面生成了难溶于水的________(填化学式)。
③沉淀器中反应的离子方程式为________。
(3)成品中 S2− 的含量可以用"碘量法"测得。称取 mg 样品,置于碘量瓶中,移取 25.00mL 0.1000mol·L−1 l的 I2−KI 溶液于其中,并加入乙酸溶液,密闭,置暗处反应 5min ,有单质硫析出。以淀粉溶液为指示剂,过量的 I2 用 0.1000mol·L −1 Na2S2O3 溶液滴定,反应式为 I2+2S2O2-3=2I-+S4O2-6 。测定时消耗 Na2S2O3 溶液体积 VmL 。终点颜色变化为________,样品中 S2− 的含量为________(写出表达式)。
下列叙述正确的是( )
| A. |
24g镁与27g铝中,含有相同的质子数 |
B. |
同等质量的氧气和臭氧中,电子数相同 |
| C. |
1mol重水与1mol水中,中子数比为2∶1 |
D. |
1mol乙烷和1 mol乙烯中,化学键数相同 |
NA 是阿伏加德罗常数的值,下列说法正确的是( )
| A. |
16.25g FeCl3 水解形成的 Fe(OH)3 胶体粒子数为 0.1NA |
| B. |
22.4L(标准状况)氩气含有的质子数为 18NA |
| C. |
92.0g甘油(丙三醇)中含有羟基数为 1.0NA |
| D. |
1.0molCH4 与 Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0NA |
[化学--选修3:物质结构与性质]
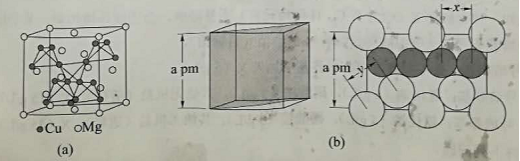
在普通铝中加入少量 Cu 和 Mg 后,形成一种称为拉维斯相的 MgCu2 微小晶粒,其分散在 Al 中可使得铝材的硬度增加、延展性减小,形成所谓"坚铝",是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是(填标号)。
A. [Ne]eqoac(○,↑)3s B. [Ne]eqoac(○,↑)eqoac(○,↓)3s C. [Ne]eqoac(○,↑)3seqoac(○,↑)3p D. [Ne]eqoac(○,↑)3p
(2)乙二胺 (H2NCH2CH2NH2) 是一种有机化合物,分子中氮、碳的杂化类型分别是 、 。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是,其中与乙二胺形成的化合物稳定性相对较高的是(填" Mg2+ "或" Cu2+ ")。
(3)一些氧化物的熔点如下表所示:
| 氧化物 |
Li2O |
MgO |
P4O6 |
SO2 |
| 熔点/°C |
1570 |
2800 |
23.8 |
-75.5 |
解释表中氧化物之间熔点差异的原因 。
(4)图(a)是 MgCu2 的拉维斯结构, Mg 以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的 Cu 。图(b)是沿立方格子对角面取得的截图。可见, Cu 原子之间最短距离 x= pm , Mg 原子之间最短距离 y= pm 。设阿伏加德罗常数的值为 NA ,则 MgCu2 的密度是 g·cm-3 (列出计算表达式)。
固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量
HCl 气体分子在
253K 冰表面吸附和溶解过程的示意图。下列叙述错误的是( )

A.冰表面第一层中, HCl 以分子形式存在
B.冰表面第二层中, H+ 浓度为 5×10-3mol·L-1 (设冰的密度为: 0.9g·cm-3 )
C.冰表面第三层中,冰的氢键网格结构保持不变
D.冰表面各层之间,均存在可逆反应 HCl⇌H++Cl-
三室式电渗析法处理含 Na2SO4 废水的原理如图所示,采用惰性电极, ab,cd 均为离子交换膜,在直流电场的作用下,两膜中间的 Na+ 和 SO42- 可通过离子交换膜, 而两端隔室中离子被阻挡不能进入中间隔室。

下列叙述正确的是( )
| A. |
通电后中间隔室的 SO2-4 离子向正极迁移, 正极区溶液 pH 增大 |
| B. |
该法在处理含 Na2SO4 废水时可以得到 NaOH 和 H2SO4 产品 |
| C. |
负极反应为 2H2O-4e-=O2+4H+ , 负极区溶液 pH 降低 |
| D. |
当电路中通过 1mol 电子的电量时, 会有 0.5mol 的 O2 生成 |
设 NA 为阿伏加德罗常数值。下列有关叙述正确的是( )
| A. |
14 g乙烯和丙烯混合气体中的氢原子数为 2NA |
| B. |
1molN2 与 4molH2 反应生成的NH 3分子数为 2NA |
| C. |
1molFe 溶于过量硝酸,电子转移数为 2NA |
| D. |
标准状况下, 2.24LCCl4 含有的共价键数为 0.4NA |
一种活性物质的结构简式为  ,下列有关该物质的叙述正确的是( )
,下列有关该物质的叙述正确的是( )
| A. | 能发生取代反应,不能发生加成反应 |
| B. | 既是乙醇的同系物也是乙酸的同系物 |
| C. | 与 |
| D. | 1mol该物质与碳酸钠反应得44g CO2 |
碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1) I2 的一种制备方法如下图所示:
净化除氯后含I海水 →AgNO3↓富集 →悬浊液 →↓沉淀Fe粉↓转化 →Cl2↓氧化 →I2
①加入 Fe 粉进行转化反应的离子方程式为_________,生成的沉淀与硝酸反应,生成________后可循环使用。
②通入 Cl2 的过程中,若氧化产物只有一种,反应的化学方程式为__________;若反应物用量比 n(Cl2)/n(FeI2)=1.5 时,氧化产物为_________;当 n(Cl2)/n(FeI2)>1.5 ,单质碘的收率会降低,原因是___________。
(2)以 NaIO3 为原料制备 I2 的方法是:先向 NaIO3 溶液中加入计量的 NaHSO3 ,生成碘化物;再向混合溶液中加入 NaIO3 溶液,反应得到 I2 ,上述制备 I2 的总反应的离子方程式为__________。
(3) KI 溶液和 CuSO4 溶液混合可生成 CuI 沉淀和 I2 ,若生成 1molI2 ,消耗的 KI 至少为_______ mol 。 I2 在 KI 溶液中可发生反应: I2+I- 。实验室中使用过量的 与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是________。
为阿伏加德罗常数的值,下列叙述正确的是( )
| A. |
重水( )中含有的质子数为 |
| B. |
的 与 完全反应时转移的电子数为 |
| C. |
环状
( |
| D. |
的 溶液中 离子数为 |
微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用如图装置处理有机废水(以含CH3COO﹣的溶液为例)。下列说法错误的是( )

A.负极反应为CH3COO﹣+2H2O﹣8e﹣═2CO2↑+7H+
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1mol电子时,模拟海水理论上除盐58.5g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2:1
NA是阿伏加德罗常数的值。下列说法正确的是( )
A.22.4L(标准状况)氮气中含有7NA个中子
B.1mol重水比1mol水多NA个质子
C.12g石墨烯和12g金刚石均含有NA个碳原子
D.1L 1mol•L﹣1NaCl溶液含有28NA个电子
化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许 离子通过,氯气的逸出口是 (填标号)。
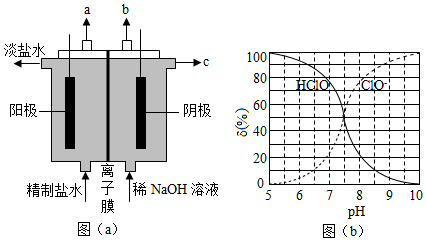
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X) ,X为HClO或ClO ﹣]与pH的关系如图(b)所示。HClO的电离常数K a值为 。
(3)Cl 2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl 2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl 2O的化学方程式为 。
(4)ClO 2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO 2、NaHSO 4、NaHCO 3的"二氧化氯泡腾片",能快速溶于水,溢出大量气泡,得到ClO 2溶液。上述过程中,生成ClO 2的反应属于歧化反应,每生成1mol ClO 2消耗NaClO 2的量为 mol;产生"气泡"的化学方程式为 。
(5)"84消毒液"的有效成分为NaClO,不可与酸性清洁剂混用的原因是 (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为 kg(保留整数)。
次氯酸钠溶液和二氯异氰尿酸钠(C3N3O3Cl2Na)都是常用的杀菌消毒剂。NaClO可用于制备二氯异氰尿酸钠。
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备NaClO的离子方程式为 ;用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是 。
(2)二氯异氰尿酸钠优质品要求有效氯大于60%.通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理为
C3N3O3Cl2﹣+H++2H2O═C3H3N3O3+2HClO
HClO+2I﹣+H+═I2+Cl﹣+H2O I2+2S2O32﹣═S4O62﹣+2I﹣
准确称取1.1200g样品,用容量瓶配成250.0mL溶液:取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000mol•L﹣1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00mL。
①通过计算判断该样品是否为优质品。
(写出计算过程,该样品的有效氯 100% )
②若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值 ( 填“偏高”或“偏低”)。
试题篮
()