砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
(1)写出基态As原子的核外电子排布式________.
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga________As.(填"大于"或"小于")
(3) 分子的立体构型为________,其中As的杂化轨道类型为________.
(4) 的熔点高于1000℃, 的熔点为77.9℃,其原因是________.
(5)GaAs的熔点为1238℃,密度为 , 其晶胞结构如图所示.
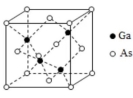
该晶体的类型为________,Ga与As以________键键合.Ga和As的摩尔质量分别为 和 , 原子半径分别为 和 ,阿伏伽德罗常数值为 ,则GaAs晶胞中原子的体积占晶胞体积的百分率为________.
[化学--选修3:物质结构与性质]
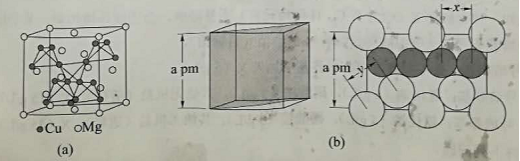
在普通铝中加入少量 和 后,形成一种称为拉维斯相的 微小晶粒,其分散在 中可使得铝材的硬度增加、延展性减小,形成所谓"坚铝",是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是(填标号)。
A. B. C. D.
(2)乙二胺 是一种有机化合物,分子中氮、碳的杂化类型分别是 、 。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是,其中与乙二胺形成的化合物稳定性相对较高的是(填" "或" ")。
(3)一些氧化物的熔点如下表所示:
| 氧化物 |
|
|
|
|
| 熔点/°C |
|
|
|
|
解释表中氧化物之间熔点差异的原因 。
(4)图(a)是 的拉维斯结构, 以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的 。图(b)是沿立方格子对角面取得的截图。可见, 原子之间最短距离 , 原子之间最短距离 。设阿伏加德罗常数的值为 ,则 的密度是 (列出计算表达式)。
Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻,能量密度大等优良性能,得到广泛应用,回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________。(填标号)
| A. | |
| B. | |
| C. | |
| D. | |
(2) 与 具有相同的电子构型, 小于 ,原因是________。
(3) 是有机合成中常用的还原剂, 中的阴离子空间构型是________。中心原子的杂化形式为________, 中,存在________(填标号)。
| A. | 离子键 |
| B. | σ键 |
| C. | π键 |
| D. | 氢键 |
(4) 是离子晶体,其晶格能可通过图(a)的 Born-Haber循环计算得到

可知,Li原子的第一电离能为________ , O=O键键能为________ , 晶格能为________
(5) 具有反莹石结构,晶胞如图(b)所示。已知晶胞参数为0.4665mm,阿伏加德罗常数的值为 ,则 的密度为 ________ (列出计算式)。
a、b、c、d为短周期元素,a的原子中只有1个电子, 和c +的电子层结构相同,d与b同族.下列叙述错误的是( )
| A. | a与其他三种元素形成的二元化合物中其化合价均为+1 |
| B. | b与其他三种元素均可形成至少两种二元化合物 |
| C. | c的原子半径是这些元素中最大的 |
| D. | d与a形成的化合物的溶液呈弱酸性 |
Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe 2+与Fe 3+离子中未成对的电子数之比为 。
(2)Li及其周期表中相邻元素的第一电离能(I 1)如表所示。I 1(Li)>I 1(Na),原因是 。 I 1(Be)>I 1(B)>I 1(Li),原因是 。
| I 1/(kJ•mol ﹣ 1) |
||
| Li 520 |
Be 900 |
B 801 |
| Na 496 |
Mg 738 |
Al 578 |
(3)磷酸根离子的空间构型为 ,其中P的价层电子对数为 、杂化轨道类型为 。
(4)LiFePO 4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO 4的单元数有 个。
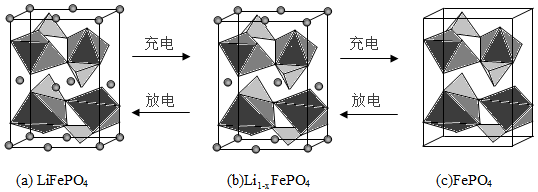
电池充电时,LiFePO 4脱出部分Li +,形成Li 1 ﹣ xFePO 4,结构示意图如(b)所示,则x= ,n(Fe 2+):n(Fe 3+)= 。
硫及其化合物有许多用途,相关物质的物理常数如下表所示:
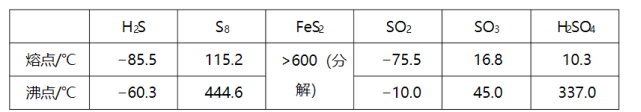
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________,基态S原子电子占据最高能级的电子云轮廓图为________ 形。
(2)根据价层电子对互斥理论, , , 的气态分子中,中心原子价层电子对数不同于其他分子的是________。
(3)图(a)为 的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为________。
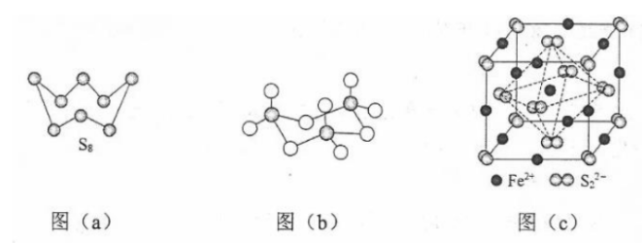
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三氯分子。该分子中S原子的杂化轨道类型为________。
(5) 晶体的晶胞如图(c)所示,晶胞边长为 , 相对式量为M、阿伏伽德罗常数的值为 , 其晶体密度的计算表达式为________ ;晶胞中 位于 所形成的正八面体的体心,该正八面体的边长为________ nm
四种短周期主族元素W,X,Y,Z的原子序数依次增大,W,X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
| A. |
简单离子半径: |
B. |
W与X形成的化合物溶于水后溶液呈碱性 |
| C. |
气态氢化物的热稳定性: |
D. |
最高价氧化物的水化物的酸性: |
【选修三:物质结构与性质】
近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为________,其沸点比NH 3的________(填"高"或"低"),其判断理由是________。
(2)Fe成为阳离子时首先失去________轨道电子,Sm的价层电子排布式为4f 66s 2 , Sm 3+的价层电子排布式为________。
(3)比较离子半径:F −________O 2−(填"大于"等于"或"小于")。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
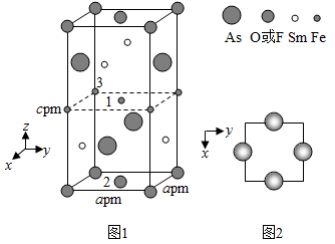
图中F −和O 2−共同占据晶胞的上下底面位置,若两者的比例依次用 x和1− x代表,则该化合物的化学式表示为________,通过测定密度 ρ和晶胞参数,可以计算该物质的 x值,完成它们关系表达式: ρ=________g·cm −3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( , , ),则原子2和3的坐标分别为________、________。
[化学一一选修3: 物质结构与性质]
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1) 基态 Ge 原子的核外电子排布式为[Ar] ,有 个末成对电子。
(2) Ge 与 C 是同族元素, 原子之间可以形成双键、叁键, 但 原子之间难以形成双键或 叁键。从原子结构角度分析,原因是 。
(3)比较下列锗卤化物的熔点和沸点, 分析其变化规律及原因 。
|
|
|
|
熔点/ |
|
26 |
146 |
沸点/ |
|
186 |
约 400 |
(4) 光催化还原 制备 反应中,带状纳米 是该反应的良好催化剂。 、Ge、O 电负性由大至小的顺序是 。
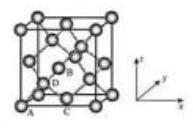
(5) Ge 单晶具有金刚石型结构, 其中 原子的杂化方式为_ , 微粒之间存在的作用力是_ 。
(6)晶胞有两个基本要素:
①原子坐标参数, 表示晶胞内部各原子的相对位置, 下图为 Ge 单晶的晶胞, 其中原子坐标参数 为 为 为 。则 原子的坐标参数为 。
②晶胞参数, 描述晶胞的大小和形状,已知 Ge 单晶的晶胞参数 , 其密度为 (列出计算式即可)。
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为nm(填标号).
| A. | 404.4 |
| B. | 553.5 |
| C. | 589.2 |
| D. | 670.8 |
| E. | 766.5 |
(2)基态K原子中,核外电子占据的最高能层的符号是________,占据该能层电子的电子云轮廓图形状为________.K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是________.
(3)X射线衍射测定等发现, 中存在 离子. 离子的几何构型为________,中心原子的杂化类型为________.
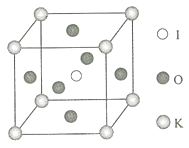
(4) 晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为 ,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示.K与O间的最短距离为________nm,与K紧邻的O个数为________.
(5)在KIO 3晶胞结构的另一种表示中,I处于各顶角位置,则K处于________位置,O处于________位置.
[化学--选修3:物质结构与性质]
研究发现,在 低压合成甲醇反应 中, 氧化物负载的 氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1) 基态原子核外电子排布式为________。元素 与O中,第一电离能较大的是________,基态原子核外未成对电子数较多的是________。
(2) 和 分子中 原子的杂化形式分别为________和________。
(3)在 低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为________,原因是________。
(4)硝酸锰是制备上述反应催化剂的原料, 中的化学键除了 键外,还存在________。
(5) 具有 型结构(如图),其中阴离子采用面心立方最密堆积方式, 射线衍射实验测得 的晶胞参数为 ,则 为________ 。 也属于 型结构,晶胞参数为 ,则 为________ 。

1934年约里奥﹣居里夫妇在核反应中用α粒子(即氦核 He)轰击金属原子 X,得到核素 Y,开创了人造放射性核素的先河: X He→ Y n其中元素X、Y的最外层电子数之和为8.下列叙述正确的是( )
A. X的相对原子质量为26
B.X、Y均可形成三氯化物
C.X的原子半径小于Y的
D.Y仅有一种含氧酸
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能 ________ (填"大于"或"小于")。原因是________。
(3) 具有较高的熔点(872 ℃),其化学键类型是________; 不溶于有机溶剂而 、 、 能够溶于乙醇、乙醚等有机溶剂,原因是________。
(4)《中华本草》等中医典籍中,记载了炉甘石( )入药,可用于治疗皮肤炎症或表面创伤。 中,阴离子空间构型为________,C原子的杂化形式为________。 (5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为________。六棱柱底边边长为 acm,高为 ccm,阿伏加德罗常数的值为 , Zn的密度为________ (列出计算式)。
东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
(1)镍元素基态原子的电子排布式为________,3d能级上的未成对电子数为________.
(2)硫酸镍溶于氨水形成[Ni(NH 3) 6]SO 4蓝色溶液.
①[Ni(NH 3) 6]SO 4中阴离子的立体构型是________.
②在[Ni(NH 3) 6]SO 4中Ni 2+与NH 3之间形成的化学键称为________,提供孤电子对的成键原子是________.
③氨的沸点________(填"高于"或"低于")膦(PH 3),原因是________;氨是________分子(填"极性"或"非极性"),中心原子的轨道杂化类型为________.
(3)单质铜及镍都是由________键形成的晶体;元素铜与镍的第二电离能分别为:I Cu=1 958kJ•mol ﹣ 1、I Ni=1 753kJ•mol ﹣ 1,I Cu>I Ni的原因是________.
(4)某镍白铜合金的立方晶胞结构如图所示
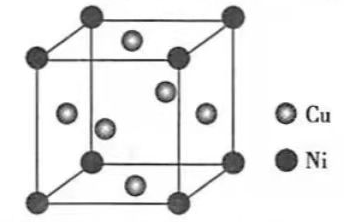
①晶胞中铜原子与镍原子的数量比为________.
②若合金的密度为d g•cm ﹣ 3,晶胞参数a=________nm.
试题篮
()