[化学--选修3:物质结构与性质]
研究发现,在 低压合成甲醇反应 中, 氧化物负载的 氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1) 基态原子核外电子排布式为________。元素 与O中,第一电离能较大的是________,基态原子核外未成对电子数较多的是________。
(2) 和 分子中 原子的杂化形式分别为________和________。
(3)在 低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为________,原因是________。
(4)硝酸锰是制备上述反应催化剂的原料, 中的化学键除了 键外,还存在________。
(5) 具有 型结构(如图),其中阴离子采用面心立方最密堆积方式, 射线衍射实验测得 的晶胞参数为 ,则 为________ 。 也属于 型结构,晶胞参数为 ,则 为________ 。

【选修三:物质结构与性质】
近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为________,其沸点比NH 3的________(填"高"或"低"),其判断理由是________。
(2)Fe成为阳离子时首先失去________轨道电子,Sm的价层电子排布式为4f 66s 2 , Sm 3+的价层电子排布式为________。
(3)比较离子半径:F −________O 2−(填"大于"等于"或"小于")。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
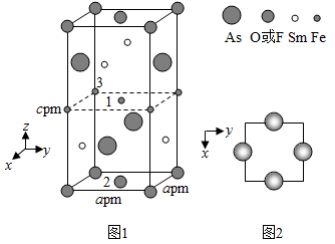
图中F −和O 2−共同占据晶胞的上下底面位置,若两者的比例依次用 x和1− x代表,则该化合物的化学式表示为________,通过测定密度 ρ和晶胞参数,可以计算该物质的 x值,完成它们关系表达式: ρ=________g·cm −3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( , , ),则原子2和3的坐标分别为________、________。
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能 ________ (填"大于"或"小于")。原因是________。
(3) 具有较高的熔点(872 ℃),其化学键类型是________; 不溶于有机溶剂而 、 、 能够溶于乙醇、乙醚等有机溶剂,原因是________。
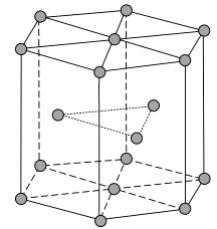
(4)《中华本草》等中医典籍中,记载了炉甘石( )入药,可用于治疗皮肤炎症或表面创伤。 中,阴离子空间构型为________,C原子的杂化形式为________。 (5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为________。六棱柱底边边长为 acm,高为 ccm,阿伏加德罗常数的值为 , Zn的密度为________ (列出计算式)。
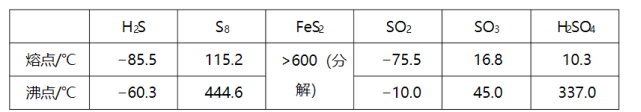
硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________,基态S原子电子占据最高能级的电子云轮廓图为________ 形。
(2)根据价层电子对互斥理论, , , 的气态分子中,中心原子价层电子对数不同于其他分子的是________。
(3)图(a)为 的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为________。
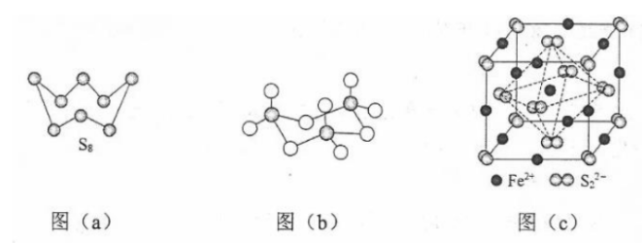
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三氯分子。该分子中S原子的杂化轨道类型为________。
(5) 晶体的晶胞如图(c)所示,晶胞边长为 , 相对式量为M、阿伏伽德罗常数的值为 , 其晶体密度的计算表达式为________ ;晶胞中 位于 所形成的正八面体的体心,该正八面体的边长为________ nm
试题篮
()