铜工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
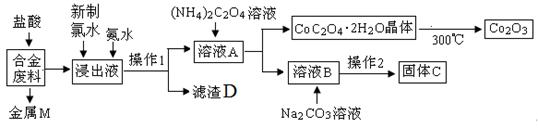
(1)金属M为 ,操作1中需要的主要玻璃仪器是玻璃棒、______、______。
(2)加入新制氯水的的作用是(用离子方程式表示) __________ 。滤渣D的主要成分是 (填化学式)。
(3)充分焙烧的化学方程式为 。如下图所示,焙烧操作中的一处错误是_________。

(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。则操作2中得到固体C的实验操作是:蒸发浓缩、 ,洗涤、干燥。90℃时Ksp(Li2CO3)的值为 。
| 温度/℃ |
10 |
30 |
60 |
90 |
| 浓度/mol・L-1 |
0.21 |
0.17 |
0.14 |
0.10 |
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:

已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
生成氢氧化物沉淀的pH
| |
Fe(OH)3 |
Zn(OH)2 |
| 开始沉淀时 |
1.5 |
8.0 |
| 完全沉淀时 |
2.8 |
11.1 |
注: 金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)“烂版液”中溶质的主要成分是Zn(NO3)2,若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式______________________。
(2)在操作①中保持pH=8的目的是_________________________________。
(3)沉淀Ⅰ的主要成分是___________________________________________。
(4)操作③中调节pH的范围是_______________;目的是_____________________________________。
孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如下图。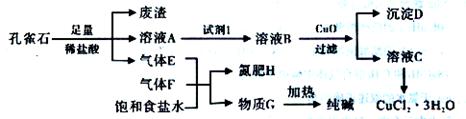
且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如下表所示。回答下列问题:
| 金属离子 |
Fe3+ |
Fe2+ |
Cu2+ |
|
| PH |
氢氧化物开始沉淀 |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀 |
3.2 |
9.0 |
6.7 |
(1)孔雀石研磨的目的是 。
(2)孔雀石的主要成分与足量稀硫酸反应的化学方程式为 。
(3)使用上图中“试剂1”的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用 (填选项序号)。
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离。则pH的范围为 。
(5)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中,其中,应先通入气体是 (填代号及对应物质的化学式)。
(6)由溶液C获得CuCl2·3H2O,需要经过 、 、过滤等操作。
(7)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O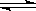 Cu(OH)2+2H+反应平衡常数 。
Cu(OH)2+2H+反应平衡常数 。
钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下:

部分含钒化合物在水中的溶解性如下表:
| 物质 |
V2O5 |
NH4VO3 |
VOSO4 |
(VO2)2SO4 |
| 溶解性 |
难溶 |
难溶 |
可溶 |
易溶 |
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有 。
(2)反应②碱浸后滤出的固体主要成分是 (写化学式)。
(3)反应④的离子方程式为 。
(4)25℃、101 kPa时,4Al(s)+3O2(g)==2Al2O3(s) ΔH1=-a kJ/mol
4V(s)+5O2(g)==2V2O5(s) ΔH2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是 _________。
(5)钒液流电池(如下图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为__________ _______,电池充电时阳极的电极反应式是_______________________。

(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO2++H2C2O4+2H+===2VO2++2CO2↑+2H2O。取25.00 mL 0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为 g/L。
【化学—选修2:化学与技术】
近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 ;用这种方法处理SO2废气的优点是 。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下: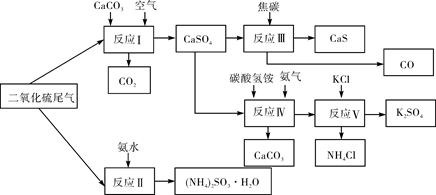
①生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 。
②下列有关说法正确的是 (填序号)。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应III中发生反应的化学方程式为CaSO4+4C CaS+4CO↑ CaS+4CO↑ |
| C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应V中的副产物氯化铵可用作氮肥 |
③反应V中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液做溶剂的原因是 。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式 。
铁的发现和大规模使用,是人类发展史上的一个光辉里程碑,它把人类从石器时代、青铜器时代带到了铁器时代,推动了人类文明的发展。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。按要求回答下列问题: 高铁酸钠主要通过如下反应制取:
2Fe(OH)3 + 3NaClO + 4NaOH = 2Na2FeO4 + 3X + 5H2O,
则X 的化学式________________ ,反应中被氧化的物质是_____________ (写化学式)。
(2)铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO 等,用硫酸渣制备铁红(Fe2O3)的过程如下: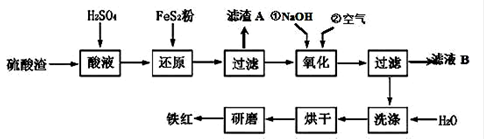
①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为_______________________ ;
“滤渣A”主要成份的化学式为____________________ 。
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:
___ FeS2 + ___Fe3 + +___ H2O = ___Fe2 + +___ SO42- + ___。
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为________________ 。
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8, 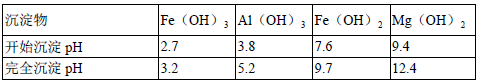
如果pH过大,可能引起的后果是____________(几种离子沉淀的pH见上表);滤液B可以回收的物质有___________(写化学式) 。
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
| 湿法 |
强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示: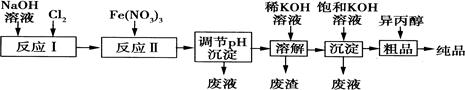
①反应I的化学方程式为 。
②反应Ⅱ的离子方程式为 。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整pH= 时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2 (填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
七铝十二钙(12CaO•7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:

(1)煅粉主要含MgO和 ;用适量的NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,该工艺中不能用(NH4)2SO4代替NH4NO3,原因是 。
(2)滤液I中的阴离子有 (忽略杂质成分的影响);若滤液I中仅通入CO2,会生成 ,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为 。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 。
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等。已知①亚氯酸钠(NaClO2)受热易分解。
②NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
③纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
(1)“反应1”需要鼓入空气,空气的作用是_______________
(2)“反应2”的化学方程式为:_______________
(3)采取“减压蒸发”而不用“常压蒸发”,原因是_______________;结晶后需要对晶体洗涤,为了减少损失,可以用_______洗澡晶体。
(4)从“母液”中可回收的主要物质是___________;
(5)要得到纯的亚氯酸钠晶体(NaClO2·3H2O),对粗产品的必须进行的操作名称__________。
某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
2.3 |
7.6 |
4.4 |
| 完全沉淀的pH |
3.2 |
9.7 |
6.4 |
(1)酸浸后加入H2O2的目的是_____________。调pH步骤中加入的试剂最好是_____________(填化学式)。实验室进行过滤操作所用到的玻璃仪器有_____________。
(2)向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式_____________。
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准。称取所制备的CuCl样品0.2500g置于一定量的0.5mol/LFeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol/L的Ce(SO4)2溶液滴定,到达滴定终点时消耗Ce(SO4)2溶液24.60mL。有关的化学反应为: Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+,通过计算说明该CuCl样品_______________(填“符合”或“不符合”)国家标准。
(4)25℃时,Ksp[Fe(OH]3]=4.0×10-38.Fe3+发生水解反应Fe3++3H2O  Fe(OH)3+3H+,该反应的平衡常数为_____________.
Fe(OH)3+3H+,该反应的平衡常数为_____________.
麦秸杆、木屑等废料经干馏制燃料气过程中产生大量的废液,俗称木醋液(主要成分乙酸,还含少量的甲醇、苯酚、焦油等)。以木醋液与白云石(主要成分2MgCO3·3CaCO3,还含有SiO2等杂质)等为原料,可制备出绿色环保型融雪剂CMA(醋酸钙、醋酸镁固体的混合物)。
CMA生产流程如下:
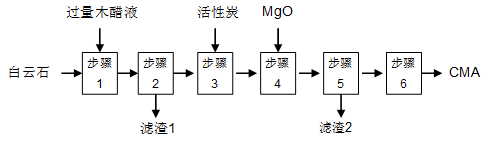
(1)步骤①发生反应的离子方程式为 ________________。
(2)滤渣1的主要成分为 (写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色焦油外,产生颜色的另一主要原因是 。
(3)步骤③是往滤液中加活性炭粉,可使滤液脱色,这是利用了活性炭具有 。
实验测知CMA中钙、镁离子的物质的量之比与出水率(与融雪效果成正比)的关系如图。
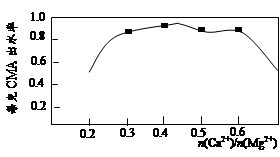
(4)由图知,当CMA中n(Ca2+)∶n(Mg2+)约为 时融雪的效果最好。(选填字母)
a.1∶2 b.3∶7 c.2∶3
步骤④的目的主要是 , 。
(5)步骤⑥包含的操作有 、过滤、洗涤及干燥。
【化学—选修2:化学与技术】普通纸张的主要成分是纤维素。在早期的纸张生产中,常采用纸表面涂明矾的工艺,以填补其表面的微孔,防止墨迹扩散,请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存.经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是______________;为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学(离子)方程式为______________;
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等.这样操作产生的主要问题是______________;
②喷洒Zn(C2H5)2.Zn(C2H5)2可以与水反应生成氧化锌和乙烷.用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理______________;
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾.钛白粉的一种工业制法是以钛铁矿(主要成分为FeTiO3)为原料按下列过程进行的,请完成下列化学方程式:
①______ FeTiO3+____ C+___ Cl2 ____ TiCl4+___ FeCl3+____CO
____ TiCl4+___ FeCl3+____CO
②______ TiCl4+____ O2 ____ TiO2+____ Cl2。
____ TiO2+____ Cl2。
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是 ,该工艺中“搅拌”的作用是 。
(2)反应Ⅱ中的离子方程式为 ,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2的作用是 。(用化学方程式表示)
(3)生产中碱式硫酸铁溶液蒸发时需要在常温减压条件下的原因是 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。(填写字母)
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
辉铜矿是冶炼铜的重要原料。
(1)工业上冶炼粗铜的某种反应为:Cu2S+O2=2Cu+SO2①当产生标况下11.2L气体时,转移电子数目为 ;
②将粗铜进行电解精炼,粗铜应与外电源的 极相接;若精炼某种仅含杂质锌的粗铜,通电一段时间后测得阴极增重ag,电解质溶液增重bg,则粗铜中含锌的质量分数为 ;
(2)将辉铜矿、软锰矿做如下处理,可以制得碱式碳酸铜:

① 步骤I中用稀硫酸浸取矿石,为提高浸取率可采取的措施有 (任写一种)。
② 步骤Ⅱ中调节浸出液pH=3.5的作用是 ;
③ 步骤Ⅰ中发生如下3个反应,已知反应Ⅰ中生成的硫酸铁起催化作用。请写出反应Ⅲ的化学方程式。
Ⅰ.Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O
Ⅱ.Cu2S+ Fe2(SO4)3 = CuSO4+CuS+2FeSO4
Ⅲ. 。
④步骤Ⅱ中,碳酸氢铵参与反应的离子方程式为 。
用霞石岩(主要成分为Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12。

溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度如上图,根据题意回答下列问题:
(1)固体M的化学式是________,X物质是________。
(2)实验室进行煅烧操作时盛放固体物质的实验仪器是________,滤液W中主要含有的离子有________。
(3)碳酸化Ⅰ中发生主要反应的离子方程式是____________。
(4)操作Ⅰ是________(填写名称),操作Ⅱ是________(选填编号)。
a.趁热过滤 b.冷却过滤 c.蒸馏 d.灼烧
(5)碳酸化Ⅱ调整pH=8的目的是______,产品K2CO3中最可能含有的杂质是__________(写化学式)。
试题篮
()