工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(已知Cd的金属活动性介于Zn和Fe之间)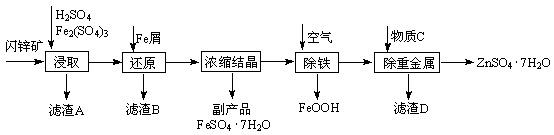
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。
该过程在空气入口处设计了一个类似淋浴喷头的装
置,其目的是 。
(4)置换法除去重金属离子Cd2+,所用物质C为 。
(5)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图所示。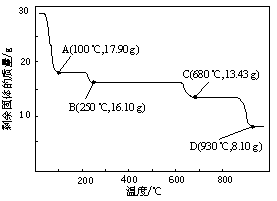
680℃时所得固体的化学式为 。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
(1)在第①步反应中,为加快反应速率,可采取的措施有 (任写一种),产生CO2气体的的方程式是 ;
(2)写出步骤②中所发生的离子方程式 ;
(3)如果蒸发得到的固体中,只含NaClO3和NaCl,为得到比较纯的NaClO3溶液,结合下面各物质的溶解度与温度的关系,
其基本操作是:将固体溶于适量水,通过 , ,便可得到较纯的NaClO3溶液。
(4)工业上也常用石墨做电极,电解酸化的MnSO4溶液来制MnO2,则阳极上所发生的离子方程式 。
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| |
Fe3+ |
Fe2+ |
Cu2+ |
| 氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀时的pH |
3.2 |
9.0 |
6.7 |
请回答下列问题。
(1)加入氧化剂的目的是 。
(2)最适合作氧化剂X的是 。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y是 。
(4)若不用物质Y而是直接用碱能不能达到目的? (填“能”或“不能”)。若能,不用回答;若不能,试解释原因: 。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是 。
(7)若向溶液Ⅱ中加入镁粉,产生的气体是 。试解释原因: 。
(8)FeCl3溶液具有净水作用的原因是 。
(10分)以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如下:
回答下列问题:
(1)写出氧化步骤中发生的主要反应的离子方程式 。
(2)如何检验中和液中的杂质离子已完全除尽? 。
(3)固体NH4Al(SO4)2·12H2O[相对分子质量:453]在加热时,固体残留率随温度的变化如图所示。
633℃时剩余固体的成分化学式为 。
(4)综上分析,流程图中M的主要成分的化学式为 ,M可用一种物质吸收以实现循环利用,该物质的名称是 。
已知:硼镁矿主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
回答下列有关问题:
(1)硼砂中B的化合价为 ,将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,该反应的离子方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应原理为 Mg+H2O2+2H+===Mg2++2H2O, 则正极反应式为 。常温下,若起始电解质溶液pH=1,则当溶液pH=6时, (填“有”或“没有”)Mg(OH) 2沉淀析出。(已知Ksp[Mg(OH) 2]=5.6×10-12)。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020 g粗硼制成的BI3完全分解,生成的I2用0.30 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。该粗硼样品的纯度为__ __(提示:I2+2 ===2I-+
===2I-+ )(结果保留一位小数)。
)(结果保留一位小数)。
实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·H2O),过程如下:
请回答下列问题:
(1)写出过程①中FeS和O2、H2SO4反应的化学方程式: 。
(2)将过程②中产生的气体通入下列溶液中,溶液会腿色的是 。
| A.品红溶液 | B.紫色石蕊试液 | C.酸性高锰酸钾溶液 | D.溴水 |
(3)过程③中,需要加入的物质是 (化学式)。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有 。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是 。
硼和铝位于同一主族,它们可以形成许多组成和性质类似的化合物。一种用硼镁矿(Mg2B2O5·H2O)制取单质硼的工艺流程图如下: 
结合流程图回答下列问题:
(1)溶液a、溶液b中溶质的化学式分别为 . 。
(2)写出步骤①的化学方程式 。
(3)写出步骤②的离子方程式 。
(4)步骤③中化学反应可以发生的原因是 。
(5)过硼酸钠晶体(NaBO3·4H2O)是一种优良的漂白剂,在70℃以上加热会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T2℃时所得晶体的化学式为 。 
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
(1)硫酸渣的成分中既能与酸又能与碱反应的是 ,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: 。
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是
(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀 |
2.7 |
3.8 |
7.5 |
9.4 |
| 完全沉淀 |
3.2 |
5.2 |
9.7 |
12.4 |
(3)滤渣A的主要成分为 ,滤液B含有的主要物质有 。
(4)如何证明洗涤环节充分洗净 。
(5)已知硫酸渣质量为a kg,假设铁红制备过程中铁元素损耗25%,最终得到铁红的质量为b kg,则原来硫酸渣中铁元素质量分数为 。(用题中所给数据列式并用最简整数比表示结果)
以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取铬酸钠(Na2CrO4)晶体的工艺流程如下: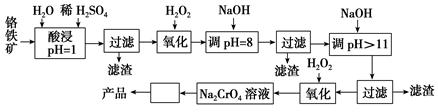
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以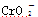 形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下。
形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下。
| 阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cr3+ |
| 开始沉淀时的pH |
2.7 |
7.6 |
9.0 |
—— |
—— |
| 沉淀完全时的pH |
3.7 |
9.6 |
11.0 |
8 |
9(>9溶解) |
(1)流程中两次使用了H2O2,分别写出反应的离子方程式:__________________、_________________。
(2)加入NaOH调节溶液的pH=8时,被除去的离子是________;调节溶液的pH>11时,被除去的离子是________。
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤不能省略,为什么?____________。
(4)流程图中 内的操作是______________________。
内的操作是______________________。
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要 等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的方法是:____________ 。
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
| 温度(℃) |
0 |
20 |
60 |
| K2SO4溶解的量(g) |
7.4 |
11.1 |
18.2 |
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体 g
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是
a、熔点较低(29℃熔化) b、能导电 c、能制冷 d、无毒
(7)上述工艺流程中体现绿色化学理念的是:
(10 分)硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、A12O3等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下:
(1)在“还原焙烧”中产生的有毒气体可能有______________。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是____________________(用离子方程式表示)。
(3)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B 是_______。
(4)煅烧A 的反应方程式是___________________________________。
(5)a g 烧渣经过上述工艺可得红氧化铁b g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于_____________(用含a、b 的表达式表示)。
实验室用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备碱式碳酸铜的主要实验流程如下。
(1)滤渣Ⅰ的成分为MnO2、单质S和 (写化学式);硫酸浸取时,Cu2S被MnO2氧化的化学方程式为 。
(2)浸取时,Fe2O3溶于硫酸的离子方程式为 ;研究发现若先除铁再浸取,浸取速率明显变慢,其可能原因是 。
(3)“赶氨”时,最适宜的操作方法是 。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是 (写化学式)。
(12 分)钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-===Fe2++TiOCl42-+2H2O。
(1)若在实验室中煅烧固体混合物,会用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有 (填仪器名称)。流程中多次涉及沉淀,则洗涤沉淀的方法是 。
(2)生产中利用滤渣A制备半导体的反应是 。
(3)滤液B中TiOCl42-转化生成TiO2的离子方程式是 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度有关,反应温度过高时,Ti元素浸出率会下降,其原因是 。
(5)写出由滤液D生成FePO4的离子方程式 。由滤液D制备LiFePO4的过程中,所需双氧水与H2C2O4的物质的量比是 。
(共12分)一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下:
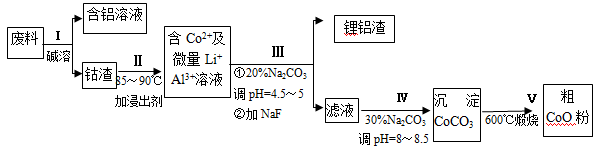
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_______________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是__________。
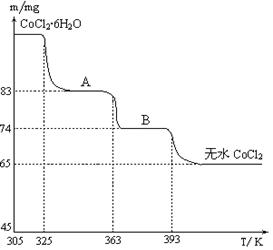
(5)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是______。
(15分)纯净的过氧化钙(CaO2)是白色粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。已知:在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下: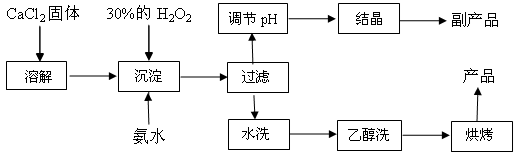
(1)“溶解”过程需要的玻璃仪器有 ,“沉淀”时需控制反应温度在0℃左右,比较简单易行的方法是 。为检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加 (填试剂),无明显现象说明“水洗”合格。
(2)“沉淀”时发生反应的离子方程式为 ;
该制法的副产品为 (填化学式);若称取11.1克无水CaCl2,理论上应该量取质量分数30﹪、密度1.1g/cm3的H2O2溶液 mL。
(3)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应;
第二步,向上述锥形瓶中加入几滴淀粉溶液;
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-→ 2I-+S4O62-(无色)】
①第三步中说明反应恰好完全的现象是
②CaO2的质量分数为 (用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能
(填“偏高”、“偏低”、“无影响”、“不能确定”)。
试题篮
()