(12分)硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4•7H2O的流程如下: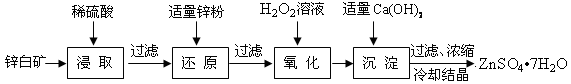
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式开始沉淀的pH分别为:2.7,5.4,7.6;完全沉淀的pH分别为:3.7,6.5,9.7。
(1)下列能提高浸取过程中浸出效率的措施有
| A.将矿石粉碎 | B.提高浸取温度 | C.适当增加硫酸的浓度 | D.搅拌并适当延长浸取时间 |
ZnO和硫酸反应的离子方程式为
(2)加入适量锌粉后溶液中存在的金属阳离子主要有
(3)氧化过程中H2O2发生反应的化学方程式为
(4)加入适量Ca(OH)2调节溶液pH至 ~ (填范围),促进Fe3+水解完全。Fe3+水解反应的平衡常数表达式K=
LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下: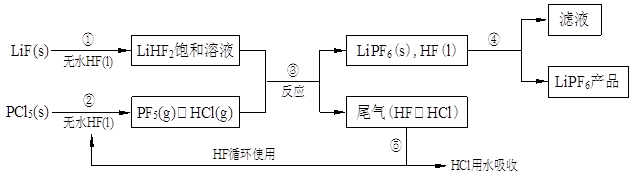
已知:HCl的沸点是-85.0℃,HF的沸点是19.5℃。
(1)第①步反应中无水HF的作用是 、 。反应设备不能用玻璃材质的原因是 (用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的 溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式: 。
(3)第④步分离采用的方法是 ;第⑤步分离尾气中HF、HCl采用的方法是 。
(4)LiPF6产品中通常混有少量LiF。取样品wg,测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为 mol(用含w、n的代数式表示)。
(9分)工业上用软锰矿(主要成分为MnO2)制备高锰酸钾的工艺流程如图所示:
(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。下列酸能用于酸化高锰酸钾溶液的是____________(填序号)。
| A.盐酸 | B.稀硫酸 | C.硝酸 | D.氢硫酸 |
(2)操作Ⅰ、Ⅱ、Ⅲ的名称分别是______________、_______________、_______________。
(3)软锰矿与过量固体KOH和KClO3在熔融状态下反应时的氧化剂是__________(填化学式)。反应后加水溶解得到的滤液中主要含有KCl和K2MnO4,则滤液酸化时发生反应的离子方程式为______________。
(4)已知KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2。取上述制得的KMnO4产品0.33 g,恰好与0.67 g Na2C2O4完全反应,则KMnO4的纯度为___________________%。
从粗产品硫酸锌固体除去铁、铜、镉等可溶性硫酸盐,从而得到纯净的硫酸锌,实验流程如下:
部分阳离子以氢氧化物形式完全沉淀时溶液的pH参见下表,请回答下列问题:
| 沉淀物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
Cu(OH)2 |
Cd(OH)2 |
Mn(OH)2 |
| pH值 |
8.0 |
9.7 |
3.2 |
6.7 |
9.4 |
10.4 |
(1)“酸浸”步骤中,为提高锌的浸出率,可采取的措施有 (任写一种)。 “酸浸”时适当补充少量水的原因是 。
(2)滤液I加入酸性KMnO4的作用为__________ ____________。加入ZnO的原因是 。
(3)滤渣III的成份主要是 。
(4)从滤液III得到晶体的操作过程为 、冷却结晶、过滤冼涤、小心干燥。
高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为: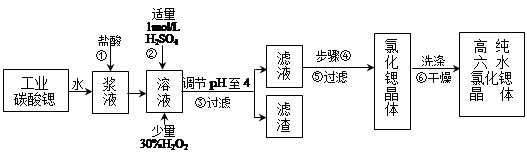
已知: Ⅰ. SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
| 沉淀完全的pH |
3.7 |
9.7 |
(1)操作①加快反应速率的措施有 (写一种)。碳酸锶与盐酸反应的离子方程式 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为 。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为_______。
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是 (填化学式)。
(5)步骤④的操作是 、 。
(6)工业上用热风吹干六水氯化锶,适宜的温度是 。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙为原料(含量为97.5%A,含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙的主要流程如下:
(1)除杂操作时加入试剂A,调节溶液的pH为8.0~8.5,以除去溶液中少量的Al3+、Fe3+。试剂A可以选择 ________________________________。
a.Ca(OH)2 b.NaOH c.NH3 d.Na2CO3
(2)检验溶液1中是否含Fe3+的方法是____________________________
(3)请指出下列操作的名称:操作1_______;操作2___________;请指出操作1中所用的玻璃仪器的名称_____________________。
(4)写出加入碳酸铵所发生的反应的离子方程式_____________;写出溶液2的一种用途_________。
(5)准确称取100 g工业碳酸钙粉末,通过上述方法理论上可以制得质量分数为99%的医药级二水合氯化钙的质量为____________。
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用煤矸石的工艺流程如下图所示。
(1)写出“酸浸”过程中主要反应的离子方程式(任写一个):
。
(2)物质X的化学式为________。“碱溶”时反应的离子方程式为_____________________________。
(3)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得Al(OH)3产品,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续的操作过程是 ,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3
(4)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3饱和溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体。结合化学平衡移动原理解释析出晶体的原因: 。
(8分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产流程如下:
(1)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL), 它的物质的量浓度是 ____mol/L。
(2)在溶液I中加入KOH固体的目的是 (填编号).
| A.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使副产物KClO3转化为KclO |
(3)从溶液II中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)与水反应时,生成红褐色胶体的同时释放出一种具有氧化性的气
体单质,请写出该反应的离子方程式: 。
利用化学原理可以对工厂排放的废水、废渣等进行有效检测。某工厂对制铬工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸液中金属离子主要是Cr3+,其次是Fe3+, Fe2+, Al3+, Ca2+, Mg2+)
常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
| 阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Ca2+ |
Cr3+ |
| 开始沉淀时的pH |
1.9 |
7.0 |
9.6 |
4.2 |
9.7 |
— |
| 沉淀完全时的pH |
3.2 |
9.0 |
11.1 |
8.0 |
11.7 |
9.0(>9.0溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是 (至少一条)
(2)调pH=4.0是为了除去 (填Fe3+, Al3+, Ca2+, Mg2+)
(3)钠离子交换树脂的原理为Mn+ + n NaR → MRn +nNa+,被交换的杂质离子是 (填Fe3+, Al3+, Ca2+, Mg2+)
(4)试配平下列氧化还原反应方程式:
Na2Cr2O7 + SO2 + H2O = Cr(OH)(H2O)5SO4 + Na2SO4
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
(1)加入少量NaHCO3的目的是调节pH在 范围内,使溶液中的 沉淀(写离子符号)。
(2)反应Ⅱ中加入NaNO2的目的是 发生反应的离子方程式为
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的最佳试剂为 。
A.溴水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(12分)以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图: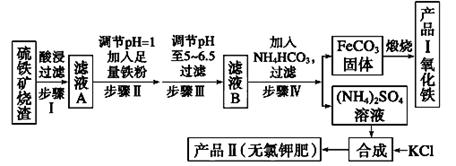

回答下列问题:
(1)酸浸、过滤后滤液A中的金属阳离子是_______________________ _______。
(2)滤液B中加入NH4HCO3溶液的离子方程式 。
(3)煅烧FeCO3生成产品I的化学反应方程式为___________ __________________。
(4)已知几种盐的溶解度随温度变化的曲线如如图所示,产品Ⅱ的化学式为 ,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是 、趁热过滤、洗涤、干燥。
(5)检验产品Ⅱ晶体中是否含有少量的氯化物杂质需用到的试剂是_______________,进一步提纯产品Ⅱ的方法是________________;
(6)步骤Ⅲ中可选用______________(填序号)试剂调节溶液的pH。
| A.稀硝酸 | B.双氧水 | C.氨水 | D.高锰酸钾溶液 |
二氧化钛(TiO2)又称钛白,工业上利用钛铁矿(主要成分FeTiO3,其中铁为正二价)为原料,采用硫酸法制得,其工艺流程如下图所示
请回答:
(1)铁矿加入硫酸反应可制得硫酸氧钛,其反应的化学方程式为:
FeTiO3+ 2H2SO4=( )TiOSO4+( )+( );
(2)为了提高二氧化钛的纯度,需要除去浸出液中的Fe3+,则加入的试剂A为 ,需过量的原因是 。
(3)操作1是 。
(4)进行操作1时需将滤液1在70-75℃,压力8000Pa的条件下真空蒸发器中进行,其原因是为了防止 ,滤液2加水稀释使硫酸氧钛(TiOSO4)水解生成偏钛酸(TiO2·nH2O),请写出该水解反应的化学方程式 。
高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为:
已知: Ⅰ. SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
| 沉淀完全的pH |
3.7 |
9.7 |
(1)操作①加快反应速率的措施有 (写一种)。
碳酸锶与盐酸反应的离子方程式 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为 。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为_______。
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是 (填化学式)。
(5)步骤④的操作是 、 。
(6)工业上用热风吹干六水氯化锶,适宜的温度是
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
某研究性学习小组利用废旧铅蓄电池阴、阳极填充物------铅膏(含PbO、PbO2、PbSO4)制备电绝缘材料三盐基硫酸铅(3PbO•PbSO4•H2O),进行资源回收研究,设计实验流程如下: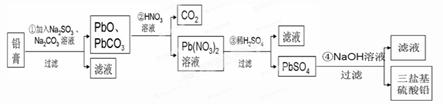
(1)步骤①铅膏中PbSO4与Na2CO3溶液反应转化为PbCO3,说明溶解度:PbSO4 (填“>”或“<”)PbCO3。
(2)步骤①中PbO2转化为PbCO3的离子方程式是(请配平此离子方程式):
(3)将步骤①和④的滤液合并,加入 PH=7,再经过 、冷却结晶、
、洗涤、干燥,可获得Na2SO4•10H2O晶体。
(4)若铅膏的质量为78g,步骤①中PbO2和PbSO4全部转化为PbCO3,且PbO未发生反应;步骤②中共收集到5.6LCO2(标准状态),步骤③中获得90.9 g PbSO4,则铅膏中PbO的质量分数为 (假设流程中原料无损失)。
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色非氯净水消毒剂和高容量电池材料。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下:
已知:NaClO不稳定,受热易分解。回答下列问题:
(1)高铁酸钠(Na2FeO4)中铁元素的化合价为 。
粗FeO酸溶过程中通入高温水蒸气,其目的是 。
(2)操作Ⅰ目的是得到高纯度FeSO4溶液,氧化Ⅰ后的溶液中如果滴加KSCN溶液,溶液变为血红色,由此推测氧化Ⅰ反应的离子方程式为 。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备:
①Cl2与NaOH溶液反应的化学方程式为_____________________________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
| 温度/0C |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
| NaClO浓度/mol·L-1 |
4.6 |
5.2 |
5.4 |
5.5 |
4.5 |
3.5 |
2 |
请描述随温度变化规律:温度小于30℃时,NaClO浓度随温度升高而增大;温度高于30℃时,____________________________________________________。NaClO浓度随温度变化具有上述规律的原因为:________________________________________________________
_______________________________________________________________________________________。
试题篮
()