二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂。
方法一:氯化钠电解法是一种可靠的工业生产ClO2气体的方法。该法工艺原理如图。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
(1)工艺中可利用的单质有__________(填化学式),发生器中生成ClO2的化学方程式为_____________。
(2)此法的缺点主要是______________________________________。
方法二:最近,科学家又研究出了一种新的制备方法,纤维素还原法制ClO2,其原理是:纤维素水解得到的最终产物X与NaClO3反应生成ClO2。
(3)配平方程式: □ (X) +□NaClO3+□H2SO4→□ClO2↑+□CO2↑+□H2O+□______
若反应中产生4.48L(折算成标准状况下)气体,电子转移________ 个。
(4)ClO2和Cl2均能将电镀废水中的CN—氧化为无毒的物质,自身被还原为Cl—。处理含CN—相同量的电镀废水,所需Cl2的物质的量是ClO2的_______倍。
方法三:实验室常用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,化学反应方程式为:2NaClO3+Na2SO3+H2SO4 2ClO2↑+2Na2SO4+H2O
2ClO2↑+2Na2SO4+H2O
(5)反应中的Na2SO3溶液中存在如下平衡:H2O H++OH-和 ________________(用离子方程式表示).
H++OH-和 ________________(用离子方程式表示).
常温下,0.1mol/L该溶液中离子浓度由大到小排列__________________(用离子符号表示)
(6)常温下,已知NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀盐酸至中性时,溶质的主要成分有________________。(用化学式表示)
实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量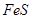 、
、 等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(
等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(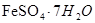 ),其过程如下:
),其过程如下: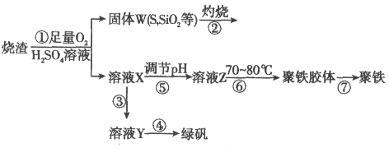
请回答下列问题:
(1)过程①中,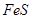 和
和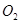 、
、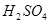 反应的化学方程式是______________。
反应的化学方程式是______________。
(2)过程②中产生的气体会对大气造成污染,可选用下列试剂中的_________吸收(填字母)。
a.浓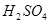 b.蒸馏水 c.
b.蒸馏水 c.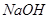 溶液 d.浓硝酸
溶液 d.浓硝酸
(3)过程③中,需要加入的物质名称是_____________。
(4)过程④中的实验操作是__________________________。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是__________________________。
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用天平称取样品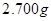 ;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为
;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为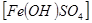
 ,则该聚铁中铁元素的质量分数为_____________(精确至0.01%)。
,则该聚铁中铁元素的质量分数为_____________(精确至0.01%)。
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有钙、铁、镁等离子)制备BaCl2·2H2O,工艺流程如图所示。已知常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4。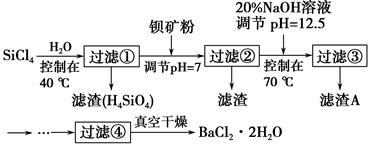
(1)SiCl4水解控制在40 ℃的原因是___________________________________。
已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g) ΔH1=+47 kJ·mol-1
Si(s)+3HCl(g)=SiHCl3(s)+H2(g) ΔH2=-189 kJ·mol-1
则由SiCl4制备硅的热化学方程式为__________________________________。
(2)加钡矿粉时生成BaCl2的离子反应方程式是_________________________。
(3)加20% NaOH溶液调节pH=12.5,得到滤渣A的主要成分是________,控制温度70 ℃的目的是____________________________________________。
(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到BaCl2·2H2O。实验室中蒸发浓缩,用到的含硅酸盐的仪器有__________种。
(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是____________。
钼(Mo)是一种过渡金属元素,通常用作合金及不镑钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备 金属钼的主要流程图,已知钼酸难溶于水。
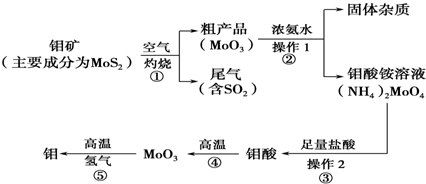
(1)写出反应①的化学方程式: 。
(2)写出反应②的化学方程式: 。
(3)反应①的尾气可以用碳酸钠溶液吸收。已知:根据表中提供的数据可知,在溶液中不能大量共存的微粒是______________;
| A.HCO3-、HSO3- | B.HCO3-、SO32- | C.HCO3-、H2S03 | D.HSO3- CO32- |
向过量碳酸钠溶液中通人少量二氧化硫,写出反应的离子方程式: 。
(4)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有 。
(5)工业上制备还原性气体CO和H2的反应原理为C02+CH4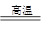 2CO + 2H2,CH4 + H2
2CO + 2H2,CH4 + H2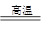 CO + 3H2,含甲烷体积分数为80%的10L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原Mo03制钼,理论上能生产钼的质量为g(小数点后保留1位,钼的相对原子质量为96)。
CO + 3H2,含甲烷体积分数为80%的10L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原Mo03制钼,理论上能生产钼的质量为g(小数点后保留1位,钼的相对原子质量为96)。
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下:
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是___________________________________
_________________________。
(2)将MnO4—氧化Fe2+的离子方程式补充完整:42—
(3)已知:生成氢氧化物沉淀的pH
| |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1 mol·L-1。
根据表中数据解释步骤Ⅱ的目的____________________________________。
(4)已知:一定条件下,MnO4—可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是
_________________________________________________________________。
②Ⅳ中加入MnSO4的目的是______________________________________。
(16分)用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下(部分操作和条件略):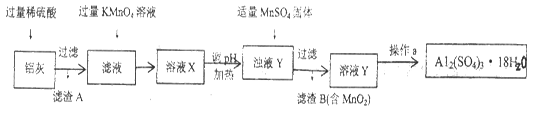
已知:一定条件下,MnO4 可与Mn2+反应生成MnO2
可与Mn2+反应生成MnO2
(1)稀H2SO4溶解Al2O3的离子方程式是__________________。
(2)已知:生成氢氧化物沉淀的pH如下表(注:金属离子的起始浓度为0.1mol·L-1)
| |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
上述流程中,加入过量KMnO4溶液的作用是________________________。(用离子方程式表示)
(3)向滤渣B中加入浓盐酸并加热,能说明沉淀中存在MnO2现象是____________。
上述流程中加入MnSO4体的目的是_______。操作a由一系列操作组成,分别是_____、___、过滤。
(4)若用沉淀溶解平衡原理分析,操作a能析出A12(SO4)3·18H2O的原因是①_______②________。
MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。实验室模拟以MnO2为原料生产MnCO3的工艺流程如下:
已知:MnCO3难溶于水和乙醇,受热易分解。
⑴ 实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、 。
⑵①检验水洗是否合格的方法是 。
②水洗结束后,用乙醇洗涤的目的是 。
⑶ MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为 ;图中点D对应固体的成分为 (填化学式)。
工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
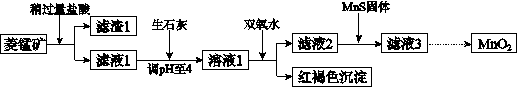
已知: 生成氢氧化物沉淀的pH
| |
Mn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
Cu(OH)2 |
| 开始沉淀时 |
8.3 |
6.3 |
2.7 |
4.7 |
| 完全沉淀时 |
9.8 |
8.3 |
3.7 |
6.7 |
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是 。盐酸溶解MnCO3的化学方程式是 。
(2)向溶液1中加入双氧水时,反应的离子方程式是 。
(3)将MnCl2转化为MnO2的一种方法是氧化法。其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+□_______=□_______+□_______+□_______。
(4)将MnCl2转化为MnO2的另一种方法是电解法。
① 生成MnO2的电极反应式是 。
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是 。
③ 若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是 。
某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
2.3 |
7.6 |
4.4 |
| 完全沉淀的pH |
3.2 |
9.7 |
6.4 |
(1)酸浸后加入H2O2的目的是_____________。调pH步骤中加入的试剂最好是_____________(填化学式)。实验室进行过滤操作所用到的玻璃仪器有_____________。
(2)向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式_____________。
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准。称取所制备的CuCl样品0.2500g置于一定量的0.5mol/LFeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol/L的Ce(SO4)2溶液滴定,到达滴定终点时消耗Ce(SO4)2溶液24.60mL。有关的化学反应为: Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+,通过计算说明该CuCl样品_______________(填“符合”或“不符合”)国家标准。
(4)25℃时,Ksp[Fe(OH]3]=4.0×10-38.Fe3+发生水解反应Fe3++3H2O  Fe(OH)3+3H+,该反应的平衡常数为_____________.
Fe(OH)3+3H+,该反应的平衡常数为_____________.
麦秸杆、木屑等废料经干馏制燃料气过程中产生大量的废液,俗称木醋液(主要成分乙酸,还含少量的甲醇、苯酚、焦油等)。以木醋液与白云石(主要成分2MgCO3·3CaCO3,还含有SiO2等杂质)等为原料,可制备出绿色环保型融雪剂CMA(醋酸钙、醋酸镁固体的混合物)。
CMA生产流程如下:
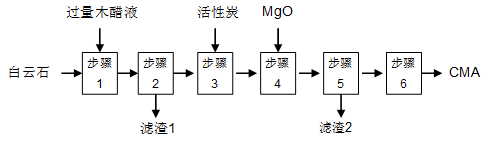
(1)步骤①发生反应的离子方程式为 ________________。
(2)滤渣1的主要成分为 (写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色焦油外,产生颜色的另一主要原因是 。
(3)步骤③是往滤液中加活性炭粉,可使滤液脱色,这是利用了活性炭具有 。
实验测知CMA中钙、镁离子的物质的量之比与出水率(与融雪效果成正比)的关系如图。
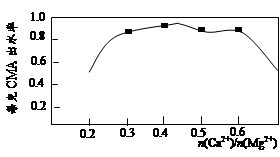
(4)由图知,当CMA中n(Ca2+)∶n(Mg2+)约为 时融雪的效果最好。(选填字母)
a.1∶2 b.3∶7 c.2∶3
步骤④的目的主要是 , 。
(5)步骤⑥包含的操作有 、过滤、洗涤及干燥。
【化学—选修2:化学与技术】普通纸张的主要成分是纤维素。在早期的纸张生产中,常采用纸表面涂明矾的工艺,以填补其表面的微孔,防止墨迹扩散,请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存.经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是______________;为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学(离子)方程式为______________;
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等.这样操作产生的主要问题是______________;
②喷洒Zn(C2H5)2.Zn(C2H5)2可以与水反应生成氧化锌和乙烷.用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理______________;
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾.钛白粉的一种工业制法是以钛铁矿(主要成分为FeTiO3)为原料按下列过程进行的,请完成下列化学方程式:
①______ FeTiO3+____ C+___ Cl2 ____ TiCl4+___ FeCl3+____CO
____ TiCl4+___ FeCl3+____CO
②______ TiCl4+____ O2 ____ TiO2+____ Cl2。
____ TiO2+____ Cl2。
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是 ,该工艺中“搅拌”的作用是 。
(2)反应Ⅱ中的离子方程式为 ,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2的作用是 。(用化学方程式表示)
(3)生产中碱式硫酸铁溶液蒸发时需要在常温减压条件下的原因是 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。(填写字母)
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
镍是有机合成的重要催化剂。某化工厂有含镍催化剂废品(主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质)。某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:

几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| 开始沉淀 |
3.8 |
2.7 |
7.6 |
7.1 |
| 完全沉淀 |
5.2 |
3.2[来 |
9.7 |
9.2 |
回答下列问题:
(1)溶液①中含有金属的离子是 。
(2)用离子方程式表示加入双氧水的目的 。
(3)操作b调节溶液范围为3.2~7.1,其目的是 ,固体②的化学式为 。
(4)操作a和c需要共同的玻璃仪器是 。上述流程中,防止浓缩结晶过
程中Ni2+水解的措施是 。
(5)如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是 。
设计实验证明产品中是否含“杂质”: 。(不考虑硫酸镍影响)
(6)取2.000 g硫酸镍晶体样品溶于蒸馏水,用0.2000 mol•L-1的EDTA(Na2H2Y)标准溶液滴定至终点,消耗EDTA标准溶液为34.50 mL。反应为Ni2++H2Y2-=NiY2-+2H+。计算样品纯度为 。(已知,NiSO4•7H2O相对分子质量为281,不考虑杂质反应)。
硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
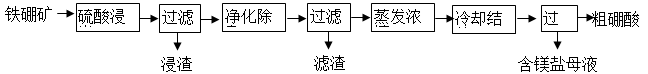
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、4.9、9.7和 12.4。
回答下列问题:
(1)为提高“浸出”速率,除适当增加硫酸浓度外,还可采取的措施有 。
(2)实验室中过滤操作所需要的玻璃仪器有:玻璃棒、 。
(3)“浸渣”中的物质是 (化学式)。
(4)“净化除杂”需先加H2O2溶液,作用是 ,然后再调节溶液的pH约为5,目的是 。
(5)“粗硼酸”中的主要杂质是 (填名称)。
(6)单质硼可用于生产具有优良抗冲击性能的硼钢。以硼酸和金属镁为原料在加热条件下可制备单质硼,用化学方程式表示制备过程 。
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用煤矸石的工艺流程如下图所示。
(1)写出“酸浸”过程中主要反应的离子方程式(任写一个):
。
(2)物质X的化学式为________。“碱溶”时反应的离子方程式为_____________________________。
(3)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得Al(OH)3产品,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续的操作过程是 ,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3
(4)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3饱和溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体。结合化学平衡移动原理解释析出晶体的原因: 。
试题篮
()