(10 分)硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、A12O3等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下:
(1)在“还原焙烧”中产生的有毒气体可能有______________。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是____________________(用离子方程式表示)。
(3)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B 是_______。
(4)煅烧A 的反应方程式是___________________________________。
(5)a g 烧渣经过上述工艺可得红氧化铁b g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于_____________(用含a、b 的表达式表示)。
多晶硅被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有铁、镁等离子)制备BaCl2·2H2O,工艺流程如下: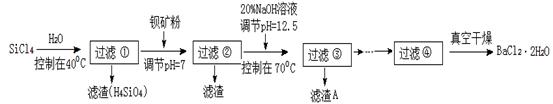
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)SiCl4水解反应的化学方程式为_________________________________________________。过滤操作需要的玻璃仪器有_________________________________。
(2)加钡矿粉调节pH=7的作用是________________________、_______________________。
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是_______________________。
(4)BaCl2滤液经__________、_________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O。
(5)10吨含78.8 % BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O_________吨。实际产量为9.70吨,相对误差为__________________%。
粗锡的主要成分是锡,另外含有锌、铜、银、金等杂质。如图甲是工业上用电解法提
纯粗锡的一种工艺流程,电解装置如图乙所示。
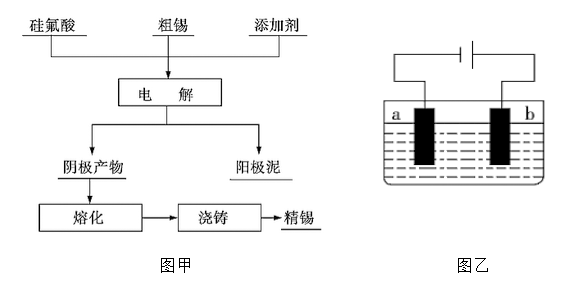
(1)流程图中的硅氟酸(化学式为H2SiF6)是一种强酸,其中Si 的化合价为 ,其电离方程式为 。
(2)硅氟酸有腐蚀性,能与SiO2反应。电解粗锡可选取的电解槽有 (选填字母代号)。
a.玻璃电解槽 b.石英电解槽
c.塑料电解槽 d.蜡制电解槽
(3)粗锡为电极 (选填“a”或“b”),该电极为 (选填“阳极”或“阴极”),电极反应式为 。
(4)阳极泥中含有的主要物质为 (写化学式)。
(5)若电解时采用SnCl2溶液作为电解液,当阴极增重11.90 g 时,电解质溶液减少的质量为0.54 g,则粗锡减少的质量为 (结果保留两位小数,不考虑进入阳极泥的物质)。
工业生产纯碱的工艺流程示意图如下:
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A 、B 。
(2)碳酸化后发生反应的化学方程式是 。
(3)向母液 (选填图中字母)中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(4)不用其它试剂,检查副产品NH4Cl是否纯净的方法及操作是 .
(5)Xg纯碱产品(含有碳酸氢钠)充分加热分解后,质量减少了Yg,则纯碱样品中碳酸氢钠的质量分数可表示为 。
(6)有人以硫酸钠和焦炭、石灰石在高温下进行煅烧,再浸取,结晶而制得纯碱。反应的化学方程式为_________ __ (已知产物之一为CaS);
(12 分)钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-===Fe2++TiOCl42-+2H2O。
(1)若在实验室中煅烧固体混合物,会用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有 (填仪器名称)。流程中多次涉及沉淀,则洗涤沉淀的方法是 。
(2)生产中利用滤渣A制备半导体的反应是 。
(3)滤液B中TiOCl42-转化生成TiO2的离子方程式是 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度有关,反应温度过高时,Ti元素浸出率会下降,其原因是 。
(5)写出由滤液D生成FePO4的离子方程式 。由滤液D制备LiFePO4的过程中,所需双氧水与H2C2O4的物质的量比是 。
某兴趣小组用废铁泥(主要成分为Fe2O3、FeO和少量Fe)制备磁性Fe3O4纳米材料的流程示意图如下:

|
 ,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。

一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如图所示:
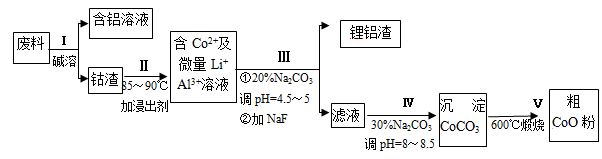
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因 。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式 。
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程IV中起的作用是_____________。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是____________(填序号)。
| A.c(Na+) = 2c(CO32-) | B.c(Na+) > c(CO32-) > c(HCO3-) |
| C.c(OH-) > c(HCO3-) > c(H+) | D.c(OH-)-c(H+) = c(HCO3-) + 2c(H2CO3) |
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是____________。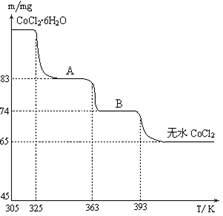
(15分)纯净的过氧化钙(CaO2)是白色粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。已知:在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下: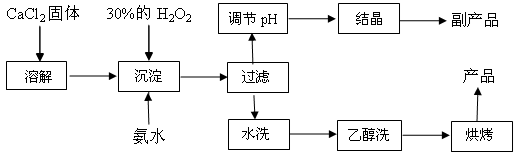
(1)“溶解”过程需要的玻璃仪器有 ,“沉淀”时需控制反应温度在0℃左右,比较简单易行的方法是 。为检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加 (填试剂),无明显现象说明“水洗”合格。
(2)“沉淀”时发生反应的离子方程式为 ;
该制法的副产品为 (填化学式);若称取11.1克无水CaCl2,理论上应该量取质量分数30﹪、密度1.1g/cm3的H2O2溶液 mL。
(3)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应;
第二步,向上述锥形瓶中加入几滴淀粉溶液;
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-→ 2I-+S4O62-(无色)】
①第三步中说明反应恰好完全的现象是
②CaO2的质量分数为 (用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能
(填“偏高”、“偏低”、“无影响”、“不能确定”)。
某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
2.3 |
7.6 |
4.4 |
| 完全沉淀的pH |
3.2 |
9.7 |
6.4 |
(1)酸浸后加入H2O2的目的是_____________。调pH步骤中加入的试剂最好是_____________(填化学式)。实验室进行过滤操作所用到的玻璃仪器有_____________。
(2)向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式_____________。
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准。称取所制备的CuCl样品0.2500g置于一定量的0.5mol/LFeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol/L的Ce(SO4)2溶液滴定,到达滴定终点时消耗Ce(SO4)2溶液24.60mL。有关的化学反应为: Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+,通过计算说明该CuCl样品_______________(填“符合”或“不符合”)国家标准。
(4)25℃时,Ksp[Fe(OH]3]=4.0×10-38.Fe3+发生水解反应Fe3++3H2O  Fe(OH)3+3H+,该反应的平衡常数为_____________.
Fe(OH)3+3H+,该反应的平衡常数为_____________.
麦秸杆、木屑等废料经干馏制燃料气过程中产生大量的废液,俗称木醋液(主要成分乙酸,还含少量的甲醇、苯酚、焦油等)。以木醋液与白云石(主要成分2MgCO3·3CaCO3,还含有SiO2等杂质)等为原料,可制备出绿色环保型融雪剂CMA(醋酸钙、醋酸镁固体的混合物)。
CMA生产流程如下:
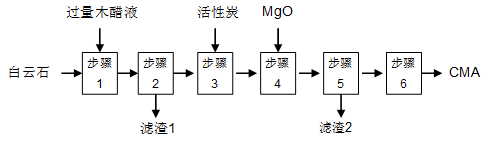
(1)步骤①发生反应的离子方程式为 ________________。
(2)滤渣1的主要成分为 (写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色焦油外,产生颜色的另一主要原因是 。
(3)步骤③是往滤液中加活性炭粉,可使滤液脱色,这是利用了活性炭具有 。
实验测知CMA中钙、镁离子的物质的量之比与出水率(与融雪效果成正比)的关系如图。
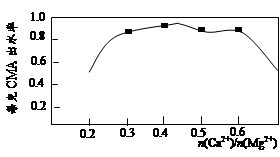
(4)由图知,当CMA中n(Ca2+)∶n(Mg2+)约为 时融雪的效果最好。(选填字母)
a.1∶2 b.3∶7 c.2∶3
步骤④的目的主要是 , 。
(5)步骤⑥包含的操作有 、过滤、洗涤及干燥。
【化学—选修2:化学与技术】普通纸张的主要成分是纤维素。在早期的纸张生产中,常采用纸表面涂明矾的工艺,以填补其表面的微孔,防止墨迹扩散,请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存.经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是______________;为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学(离子)方程式为______________;
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等.这样操作产生的主要问题是______________;
②喷洒Zn(C2H5)2.Zn(C2H5)2可以与水反应生成氧化锌和乙烷.用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理______________;
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾.钛白粉的一种工业制法是以钛铁矿(主要成分为FeTiO3)为原料按下列过程进行的,请完成下列化学方程式:
①______ FeTiO3+____ C+___ Cl2 ____ TiCl4+___ FeCl3+____CO
____ TiCl4+___ FeCl3+____CO
②______ TiCl4+____ O2 ____ TiO2+____ Cl2。
____ TiO2+____ Cl2。
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是 ,该工艺中“搅拌”的作用是 。
(2)反应Ⅱ中的离子方程式为 ,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2的作用是 。(用化学方程式表示)
(3)生产中碱式硫酸铁溶液蒸发时需要在常温减压条件下的原因是 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。(填写字母)
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
镍是有机合成的重要催化剂。某化工厂有含镍催化剂废品(主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质)。某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:

几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| 开始沉淀 |
3.8 |
2.7 |
7.6 |
7.1 |
| 完全沉淀 |
5.2 |
3.2[来 |
9.7 |
9.2 |
回答下列问题:
(1)溶液①中含有金属的离子是 。
(2)用离子方程式表示加入双氧水的目的 。
(3)操作b调节溶液范围为3.2~7.1,其目的是 ,固体②的化学式为 。
(4)操作a和c需要共同的玻璃仪器是 。上述流程中,防止浓缩结晶过
程中Ni2+水解的措施是 。
(5)如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是 。
设计实验证明产品中是否含“杂质”: 。(不考虑硫酸镍影响)
(6)取2.000 g硫酸镍晶体样品溶于蒸馏水,用0.2000 mol•L-1的EDTA(Na2H2Y)标准溶液滴定至终点,消耗EDTA标准溶液为34.50 mL。反应为Ni2++H2Y2-=NiY2-+2H+。计算样品纯度为 。(已知,NiSO4•7H2O相对分子质量为281,不考虑杂质反应)。
硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
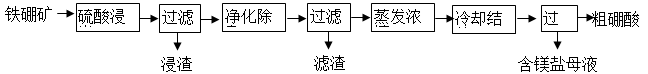
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、4.9、9.7和 12.4。
回答下列问题:
(1)为提高“浸出”速率,除适当增加硫酸浓度外,还可采取的措施有 。
(2)实验室中过滤操作所需要的玻璃仪器有:玻璃棒、 。
(3)“浸渣”中的物质是 (化学式)。
(4)“净化除杂”需先加H2O2溶液,作用是 ,然后再调节溶液的pH约为5,目的是 。
(5)“粗硼酸”中的主要杂质是 (填名称)。
(6)单质硼可用于生产具有优良抗冲击性能的硼钢。以硼酸和金属镁为原料在加热条件下可制备单质硼,用化学方程式表示制备过程 。
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用煤矸石的工艺流程如下图所示。
(1)写出“酸浸”过程中主要反应的离子方程式(任写一个):
。
(2)物质X的化学式为________。“碱溶”时反应的离子方程式为_____________________________。
(3)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得Al(OH)3产品,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续的操作过程是 ,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3
(4)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3饱和溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体。结合化学平衡移动原理解释析出晶体的原因: 。
试题篮
()