Ⅰ.“中东有石油,中国有稀土”。稀土金属是我国战略性资源,应加以保护。稀土金属是周期表中ⅢB族中钪、钇和镧系十七种元素的总称,都是很活泼的金属,性质极为相似,常见化合价为+3价。钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下: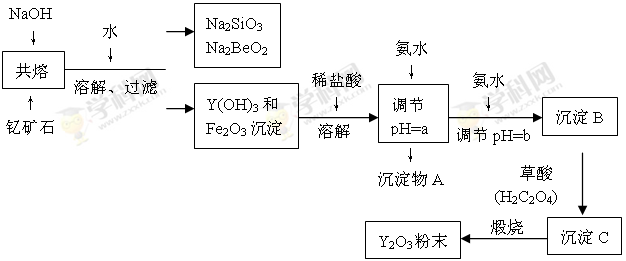
已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe3+ |
2.7 |
3.7 |
| Y3+ |
6.0 |
8.2 |
②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则最好选用盐酸和 (填字母)
两种试剂,通过必要的操作即可实现。
A.NaOH溶液 B、氨水 C、CO2 D、HNO3
(2)流程图中用氨水调节pH=a时生成沉淀的化学式为 ,继续加氨水调至pH=b,此时发生反应的离子方程式为 。
(3)沉淀C为草酸钇,写出草酸钇隔绝空气加热生成Y2O3的化学方程式: 。
Ⅱ镧系元素铈(Ce)是地壳中含量最高的稀土元素,在加热的条件下CeCl3易发生水解。
(4)无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备,其中NH4Cl的作用是___
。
(5)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过反应形成Ce(OH)4沉淀得以分离, 写出反应的离子方程式 。
[化学-选修化学与技术]
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度/℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下:
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的 Mn2+氧化成MnO2,反应的离子反应方程式为 。加热煮沸的主要目的 是 。
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 。过滤III需趁热过滤的理由是
二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(1)① TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________;
② 检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
(2)Fe2O3与H2SO4反应的离子方程式是 。
(3)甲溶液中除含TiO2+之外还含有的金属阳离子有 。
(4)加Fe的作用是 。
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
反应②的方程式是 ,该反应需要在Ar气氛中进行,请解释原因:_____________。
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:


图Ⅰ 图Ⅱ
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
7.7 |
| 沉淀完全的pH |
3.7 |
9.7 |
9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价: (若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为 ______mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为 。
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。工业上常采用NaClO氧化法生产,其生产工艺如下:
主要反应为:3NaClO+2Fe(NO3)3+10NaOH = 2Na2FeO4↓+3NaCl+6NaNO3+5H2O
Na2FeO4+2KOH=K2FeO4+2NaOH。
(1)写出反应①的离子方程式: 。
(2)从“混合物II”中分离出K2FeO4后,会有副产品,它们都是重要的化工产品,其中一种在工业上用作氯碱工业原料的物质是 。
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。图Ⅰ为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;图Ⅱ为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。
图Ⅰ 图Ⅱ
根据上图分析:工业生产中最佳温度为 ℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为 。
重晶石矿(主要成分为硫酸钡)因为含有Fe2O3、MnO及炭质等杂质而常呈深褐色。工业上将重晶石矿粉碎后与硫酸、铝粉在反应槽中混合加热(即“漂白”),再经水洗等一系列工序制得白色的重晶石填料,广泛用作纸张、油漆等的填充剂。已知MnO是碱性氧化物,Al粉可以将深色的Fe3+转化为浅色的Fe2+。
重晶石填料的生产工艺流程为:
(1)在该流程中,为加快“漂白”速度,采取的措施有 、
。
(2)硫酸起到了“漂白”的作用。请写出硫酸直接起到该作用时的化学方程式:
、 。
(3)二次漂白水洗过滤后,检验滤渣不含Fe2+离子的方法是
、 。
(4)二次漂白前,煅烧的主要目的是 。将煅烧后的固体磨成细粉,使用的是加有刚玉球的振动磨。这说明刚玉具有很高的 。
(5)工业生产中为了充分利用资源,将滤液经过处理得到化工原料Fe2O3。操作过程是:
①滤液中通入过量Cl2,其目的是 。
②再加入适量NaOH来调节溶液的pH ,其目的是 ,调节溶液的pH范围为 。
有关离子开始沉淀及完全沉淀时的pH如下:
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
7.6 |
9.7 |
| Fe3+ |
2.7 |
3.7 |
| Al3+ |
3.8 |
4.7 |
| Mn2+ |
8.3 |
9.8 |
(6)最后通过 、 得到氧化铁。
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某化学探究小组设计如下方案制备上述两种产品:
请回答下列问题:
(1)检验固体铁的氧化物中铁的化合价,应使用的试剂是 (填标号)
| A.稀硫酸 | B.稀硝酸 | C.KSCN溶液 | D.酸性高锰酸钾溶液 |
(2)在溶液Ⅰ中加入NaClO3,写出其氧化Fe2+的离子方程式: 。
(3)Fe2O3与KNO3和KOH的混合物加热共融可制得高铁酸鉀。完成并配平下列化学方程式:
□Fe2O3+□KNO3+□KOH——□ +□KNO2+□ 。
(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol·L—1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I—=2Fe2++I2、I2+2S2O32—=2I—+S4O62—。
①写出滴定选用的指示剂 ,滴定终点观察到的现象 。
②溶液I中铁元素的总含量为 g·L—1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会 (填“偏高”、“偏低”、“不变”)。
工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:①Li2O·Al2O3·4SiO2 + H2SO4(浓) Li2SO4 + Al2O3·4SiO2·H2O↓
Li2SO4 + Al2O3·4SiO2·H2O↓
| T/℃ |
20 |
40 |
60 |
80 |
| S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
| S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是 。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3,写出生成滤渣2反应的离子方程式: 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
①将粗产品Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解。阳极的电极反应式是 。
②电解后向产品LiOH溶液中加入过量NH4HCO3溶液生成Li2CO3反应的化学方程式是 。
锰锌铁氧体可用于隐形飞机上吸收雷达波涂料。现以废旧锌锰电池为原料制备锰锌铁氧体的主要流程如下:
(1)酸浸时,二氧化锰被双氧水还原的化学方程式为_______。
(2)活性铁粉除汞时,铁粉的作用是______ (填“氧化剂”或“还原剂”或“吸附剂”)。
(3)除汞是以氮气为载气吹入滤液带出汞蒸汽经KMnO4溶液进行吸收而实现的。如下图是KMnO4溶液处于不同pH时对应的Hg去除率变化图,图中物质为Hg与 MnO4-在该pH范围内的主要产物。
①请根据该图给出pH对汞去除率影响的变化规律:______。
②试猜想在强酸性环境下汞的单位时间去除率高的原因:______。
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该铁氧体组成____________。
(5)经测定滤液成分后同时加入一定量的MnSO4和铁粉的目的是______。
由软锰矿(主要成分为MnO2)制备KMnO4的实验流程可表示如下: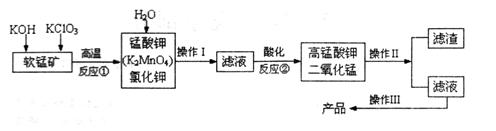
(1)操作Ⅱ的名称是____________。
(2)可循环利用的物质____________(填化学式)。
(3)反应②的产物中,氧化产物与还原产物的物质的量之比是______。
(4)反应②中“酸化”时不能选择下列酸中的______(填字母序号)
A.稀盐酸 B.稀硫酸 C.稀醋酸
(5)电解猛酸钾溶液也可以得到高锰酸钾,其阴极反应式为:2H2O+2e-=2OH-+H2↑,如下图,b作____________极,电解池的阳极反应式是____________;若电解过程中收集到2.24L H2(标准状况),则得到高锰酸 钾____________克。(提示:阴离子放电顺序MnO42->OH-)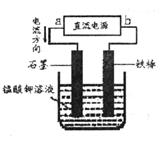
从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2等)中回收V2O5的一种生产工艺流程示意图如下,请回答下列问题: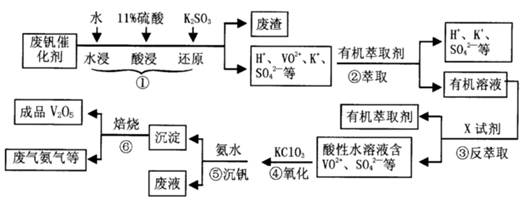
(1)步骤①中废渣的主要成分是 ,③中X试剂为 。
(2)实验室中进行萃取分液操作时,注入萃取剂,充分振荡,将分液漏斗于铁圈上静置,当液体分层后,接下来的操作是 。
(3)②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂)。
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是 。
2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是 。
(4)请完成④中的反应离子方程式:
□ClO3- + □VO2+ +□H+ =□VO3+ + □ +□
(5)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
| 钒沉淀率% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH值为 。
(6)该工艺流程中,可以循环利用的物质有 。
分子筛具有均匀的微孔结构,分子筛筛分作用见下图。由于分子筛具有吸附能力高,热稳定性强等其它吸附剂所没有的优点,使得分子筛获得广泛的应用。某种型号的分子筛的工业生产流程可简单表示如下:

在加NH3·H2O调节pH的过程中,若pH控制不当会有Al(OH)3生成,假设生产流程中铝元素和硅元素均没有损耗,钠原子的利用率为10%。
(1)分子筛的孔道直径为4A(1 A=10-10m)称为4A型分子筛,当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得3A型分子筛。要高效分离正丁烷(分子直径为4.65A)和异丁烷(分子直径为5.6A)应该选用 型分子筛。
(2)A12(SO4)3溶液与Na2SiO3溶液反应生成胶体的离子方程式为
(3)该生产流程中所得滤液里含有的离子除H+、OH-外,主要为 ;检验其中金属阳离子的操作方法是
(4)加NH3·H2O调节pH后,加热到90℃并趁热过滤的原因可能是
(5)该生产流程中所得分子筛的化学式为
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。
(1)碱浸前将铭铁矿粉碎的作用是
(2)步骤③调节pH后过滤得到的滤渣是 。
(3)操作④中,酸化时,CrO2- 4转化为Cr2O2- 7,写出平衡转化的离子方程式
;
(4)用简要的文字说明操作⑤加入KCl的原因 。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O2- 3=2I- +S4O2- 6)
①判断达到滴定终点的依据是 ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应) (保留2位有效数字)。
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是 。
步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、 。
(1)步骤④的离子方程式是 。
(1)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及 。
(1)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为 。
(1)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因 。
(1)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示) 。
用芒硝(Na2SO4 °10H2O)制备纯碱、明矾铵[(NH4)2Al(SO4)2°12H2O]的生产工艺流程如下图:
(1)溶液C中的溶质主要是_____________
(2)明矾铵的溶液呈_____性,明矾铵可用于净水,用离子方程式说明其原理______________________
(3)过程Ⅰ中的反应温度不能超过40℃,其原因是______________________________
(4)运用化学平衡原理解释Na2SO4稍过量的原因
(5)若将Al2(SO4)3加入到A中会产生大量的沉淀和气体,导致明矾铵的产量降低,请用离子方程式解释产生该现象的原因是___________________________________________
(6)溶液E中的溶质离子为__________________
(7)已知明矾铵的溶解度随着温度的升高而增大,过程Ⅱ中得到明矾铵的系列实验操作是: 、 、过滤、洗涤、干燥。
试题篮
()