实验室中,用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高纯氧化铁(a—Fe2O3)的步骤如下:
回答下列问题:
(1)上述实验中,加入铁粉的作用是____________。(用离子方程式表示)实验中检验溶液x中的离子是否与铁粉完全反应的试剂是____________溶液
(2)实验室欲用18.4 mol·L-1的浓硫酸配制100 mL5.0mol·L-1的硫酸溶液,所用仪器除胶头滴管、量筒、烧杯、玻璃棒外,还有_________(填写仪器名称);
(3)某同学用下图所示装置实现向溶液Y中通入NH3和CO2
①上述装置的中,仪器a的名称是_______;装置B的作用是____________________。
②圆底烧瓶内放置的固体药品为________(填化学式);试管内发生反应的化学方程式为__________。
③甲、乙、丙三位同学分别用上述装置进行实验,装置C的试剂瓶内溶液体积相等。
若甲、乙两同学实验中,通入的NH3和CO2的物质的量之比分别为2:l和l:l,恰好完全反应后,溶液中水的电离程度a甲________(填“>”“=”或“<”)a乙。
若丙同学未用装置D,则反应后溶液中离子浓度间的关系为[H+]+[NH4+]=_______。
氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
回答下列问题:
(1)步骤①中得到的氧化产物是_______(填离子符号),溶解温度应控制在60~70℃,原因是________。
(2)写出步骤③中主要反应的离子方程式___________。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_________(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是_____________。
(5)准确称取所制备的氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用amol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液bmL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________。
七铝十二钙(12CaO•7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:

(1)煅粉主要含MgO和 ;用适量的NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,该工艺中不能用(NH4)2SO4代替NH4NO3,原因是 。
(2)滤液I中的阴离子有 (忽略杂质成分的影响);若滤液I中仅通入CO2,会生成 ,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为 。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 。
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下: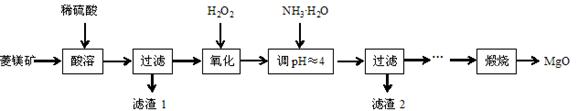
(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。
(3)滤渣2的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C  2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C  MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C  MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集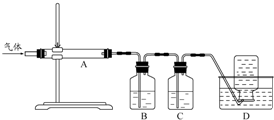
①D中收集的气体是 。
②B中盛放的溶液可以是 。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:
(16分)用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下(部分操作和条件略):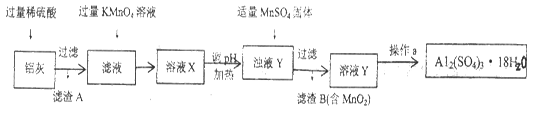
已知:一定条件下,MnO4 可与Mn2+反应生成MnO2
可与Mn2+反应生成MnO2
(1)稀H2SO4溶解Al2O3的离子方程式是__________________。
(2)已知:生成氢氧化物沉淀的pH如下表(注:金属离子的起始浓度为0.1mol·L-1)
| |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
上述流程中,加入过量KMnO4溶液的作用是________________________。(用离子方程式表示)
(3)向滤渣B中加入浓盐酸并加热,能说明沉淀中存在MnO2现象是____________。
上述流程中加入MnSO4体的目的是_______。操作a由一系列操作组成,分别是_____、___、过滤。
(4)若用沉淀溶解平衡原理分析,操作a能析出A12(SO4)3·18H2O的原因是①_______②________。
实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量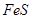 、
、 等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(
等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(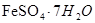 ),其过程如下:
),其过程如下: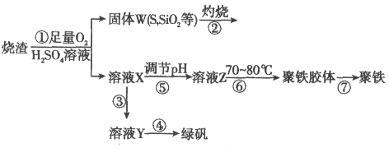
请回答下列问题:
(1)过程①中,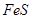 和
和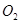 、
、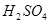 反应的化学方程式是______________。
反应的化学方程式是______________。
(2)过程②中产生的气体会对大气造成污染,可选用下列试剂中的_________吸收(填字母)。
a.浓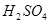 b.蒸馏水 c.
b.蒸馏水 c.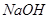 溶液 d.浓硝酸
溶液 d.浓硝酸
(3)过程③中,需要加入的物质名称是_____________。
(4)过程④中的实验操作是__________________________。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是__________________________。
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用天平称取样品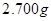 ;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为
;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为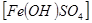
 ,则该聚铁中铁元素的质量分数为_____________(精确至0.01%)。
,则该聚铁中铁元素的质量分数为_____________(精确至0.01%)。
高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂。
(1)Na2FeO4中铁元素化合价是 价,Na2FeO4具有较强的 (填“氧化性”或“还原性”)。
(2)用Na2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原因是 (用离子方程式表示)。
(3)工业上可用FeCl3、NaOH 、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:2FeCl3 + 10NaOH + 3NaClO = 2 + 5 + 9 。
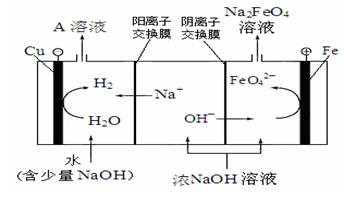
(4)工业上还可用电解浓NaOH溶液的方法制Na2FeO4 。
①若电解所需的浓NaOH溶液为16 mol/L,则在实验室配制500 mL该浓度的溶液需NaOH的质量为
______g;
② 电解浓NaOH溶液制备Na2FeO4,其工作原理如下图所示:
阳极的电极反应式为 ;可循环使用的物质是 。
高纯度的氢氧化镁广泛应用于医药、电力等领域。镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如下:

已知1:溶液Ⅰ中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子
2:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
| |
Fe3+ |
Al3+ |
Fe2+ |
Mg2+ |
| 开始沉淀时 |
1.5 |
3.3 |
6.5 |
9.4 |
| 沉淀完全时 |
3.7 |
5.2 |
9.7 |
12.4 |
(1)向溶液Ⅰ中加入X的作用是____________。
(2)向溶液Ⅰ中加入的两种试剂先后顺序是______________(填化学式)。
(3)加入H2O2溶液反应的离子方程式是__________________。
(4)下图是Mg2+转化率随温度t的变化示意图:

① t1前Mg2+转化率增大的原因是____________;t1后Mg2+转化率下降的原因是(用化学方程式表示)______________。
② 向溶液Ⅱ中加入氨水反应的离子方程式是_________。
铝是用途广泛的金属材料,目前工业上主要用铝土矿(主要成分含氧化铝、氧化铁)来制取铝,其常见的过程如下:

请回答下列问题:
(1)沉淀B的化学式为 ,溶液C中阴离子主要是 。
(2)操作Ⅰ是 (填操作名称)
(3)写出①过程中发生反应的离子方程式 。
(4)Al(OH)3沉淀必须进行洗涤才能通过操作Ⅳ获得纯净Al2O3,操作Ⅳ是 (填操作名称),简述洗涤沉淀的操作方法: 。
(5)生产过程中,除水、CaO和CO2可以循环使用外,还可循环使用的物质有 (填化学式)。
(6)电解Al2O3制取金属Al的阳极电极反应式为 。
粗铜精炼后的阳极泥含有Cu、Au(金)、Pb和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如下:

(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有: 和Cu-2e一=Cu2+。
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是 ,焙烧后的阳极泥中除含金、PbSO4外,还有 (填化学式)。
(3)操作I的主要步骤为_____________过滤、洗涤、干燥,操作II的名称是 。
(4)写出用SO2还原AuCl4一的离子方程式______________________。
(5)为了减少废液排放、充分利用有用资源,工业上将滤液l并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法_____________________。
(6)已知常温时,Ksp(PbCO3)=l.46×l0-13,Ksp(PbSO4)= 1.82×l0-8,用离子方程式表示加入碳酸钠溶液的作用____________________________。
亚氯酸钠(NaClO2)是一种高效氧化剂和优质漂白剂。一种以氯酸钠(NaClO3)为原料制备NaClO2粗品的工艺流程如下图所示:

已知:
①纯ClO2易分解爆炸,空气中ClO2 的体积分数在10%以下比较安全;
②NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
③含水NaClO2受热易分解。
(1) 试剂A 可以选择___________(填字母序号)。
a. SO2 b. 浓硝酸 c. KMnO4
(2) 反应Ⅱ的离子方程式为_________。
(3) 下列关于上述流程的说法中,合理的是________(填字母序号)。
a. 反应Ⅰ进行过程中应持续鼓入空气
b. 反应Ⅰ后得到的母液中,溶质的主要成分是NaCl
c. 反应Ⅱ中NaOH 应过量
(4) 已知压强越大,物质的沸点越高。反应Ⅱ结束后采用“减压蒸发”操作的原因是____________。
(5) 中间产物二氧化氯(ClO2)在生产生活中也有广泛应用。用ClO2处理泄漏的氰化钠(NaCN),得到无毒的NaCl、N2和CO2。若处理含NaCN4×10-5mol ·L-1的废水 1000L,至少需要ClO2的质量为___________g。
软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下: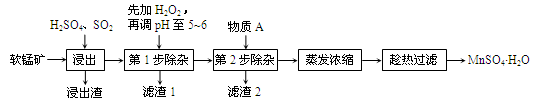
已知:Fe3+、Al3+、Mn2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、10.4、12.4;温度高于27℃时,MnSO4的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为________。
(2)“浸出”过程中Fe2O3转化为Fe3+和Fe2+,相关反应的离子方程式为________。
(3)“滤渣1”的主要成分是__________,“调pH至5~6”所加的试剂是_________(填“石灰水”或“稀硫酸”)。
(4)根据下表数据,选择“第2步除杂”所加的物质A(由一种阳离子和一种阴离子组成),物质A的化学式为________。
 阴离子 阴离子Ksp  阳离子 |
CO32- |
F- |
OH- |
| Ca2+ |
5.0×10-9 |
1.5×10-10 |
4.7×10-6 |
| Mg2+ |
3.8×10-6 |
7.4×10-11 |
5.6×10-12 |
| Mn2+ |
2.2×10-11 |
5.3×10-3 |
2.1×10-13 |
| Zn2+ |
1.2×10-10 |
3.0×10-2 |
6.9×10-17 |
(5)采用“趁热过滤”操作的原因是________。
碱式碳酸锌【xZnCO3·yZn(OH) 2·zH2O】主要用做橡胶硫化促进剂,工业上利用锌焙砂(主要成分是ZnO、SiO2,还含有Fe2O3、CuO等)生产碱式碳酸锌的工艺流程如下:
请回答下列问题:
(1)向锌焙砂加入足量稀硫酸进行酸溶的过程中,所发生反应的离子方程式为 、___ _(写其中任意两个)。
(2)从滤渣I中分离出SiO2的部分流程如下: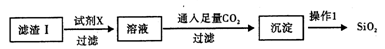
①试剂X的名称为____ 。②操作1的方法为________ 。
(3)加入锌粉的目的是____ ,从滤渣Ⅱ中获取铜的操作方法为 。
(4)高温煅烧碱式碳酸锌得到ZnO,取碱式碳酸锌3.41g,在高温下煅烧至恒重,得到固体2.43g和标准状况下CO2 0.224L,则该碱式碳酸锌的化学式为 。
I 铁及其化合物之间的相互转化可用下式表示:

回答下列有关问题:
(1)检验硫酸铁溶液中是否存在Fe2+的方法是___________________。
(2)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2 = 2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的还原剂是___________,每生成l mol Na2FeO4转移____________mol电子。
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:
Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:_______________。
②若反应过程中转移了0.3 mol电子,则还原产物的物质的量为___________。
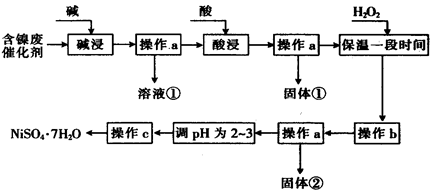
II某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备 。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
部分阳离子以氢氧化物形式沉淀时的pH如下:
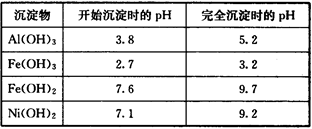
(1)“碱浸”过程中发生反应的离子方程式是
(2)“酸浸”时所加入的酸是 (填化学式)。
(3)加入H2O2时发生反应的离子方程式为
(4)操作b为调节溶液的pH,你认为pH的调控范围是
(5)NiS04·7Hz0可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为 。
某化工厂冶炼金属、回收硫的工艺流程如下:

I.回收硫
(1)工业上,采用饱和亚硫酸钠溶液吸收烟气中二氧化硫,写出离子方程式: 。然后,加热吸收液收集SO2。将二氧化硫、空气在稀硫酸中构成原电池,负极反应式为 。
II.冶炼铜
(2)工业上,火法冶炼铜分两步:第一步,含铜矿(主要成分是Cu2S)在空气中煅烧生成氧化亚铜和刺激性气味气体;第二步,氧化亚铜和铜矿在高温下反应生成铜和刺激性气体。写出冶炼铜的总反应方程式: 。
(3)用电解法精炼粗铜(含银、金、铁、锌杂质),装置如图所示。下列说法不正确的是 。

| A.Y极为粗铜、X极为纯铜 |
| B.X极净增质量等于Y极净减质量 |
| C.铜盐溶液作精炼铜的电解质溶液 |
| D.若电路有1 mol电子转移,则X极净增32 g |
(4)几种金属离子的沉淀pH:
| 金属氢氧化物 |
开始沉淀pH |
完全沉淀的pH |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.7 |
| Cu(OH)2 |
4.6 |
6.4 |
| Zn(OH)2 |
5.9 |
8.9 |
铜盐溶液中Fe2+、Zn2+对精炼铜可能会产生影响。工业上,除去Fe2+方法是,在酸性混合溶液中加入 (选填:双氧水、次氯酸钠、氯水或高锰酸钾溶液)将Fe2+氧化成Fe3+,离子方程式为 。加入碱调节溶液pH范围为 。
试题篮
()