将镁条在空气中燃烧的全部产物(氧化镁和氮化镁)溶解在50mL 1.8mol·L-1的盐酸中,再以20mL 0.9mol·L-1的NaOH中和多余的酸。然后再向溶液中加入过量的NaOH溶液将氨全部蒸发出来,用足量的盐酸吸收,经测定氨的质量为0.102g,求镁条的质量。(提示:N2+3Mg Mg3N2,Mg3N2+8HCl3MgCl2+2NH4Cl)
Mg3N2,Mg3N2+8HCl3MgCl2+2NH4Cl)
工业上制取铝的流程如下:

注:冰晶石的作用是使E在较低温度下熔化。
(1)试写出下列物质的化学式:
A____________,B____________,C____________,D____________,E____________。
(2)在用此法制取铝时,分析铝土矿和赤泥(提取Al2O3之后的残渣)所得数据如下:
| Al2O3 |
Fe2O3 |
Na2O |
铝土矿 |
| 55% |
16% |
0% |
赤泥 |
| 15% |
48% |
8% |
|
试求制取1 t Al2O3所需铝矾土和苛性钠的质量。
聚甲基丙烯酸羟乙脂的结构简式为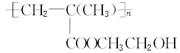 ,它是制作软质隐形眼镜的材料。请写出下列有关反应的化学方程式:
,它是制作软质隐形眼镜的材料。请写出下列有关反应的化学方程式:
(1)由甲基丙烯酸羟乙脂制备聚甲基丙烯酸羟乙脂。
(2)由甲基丙烯酸制备甲基丙烯酸羟乙脂。
(3)由乙烯制备乙二醇。
已知卤代烃(R—X,—R表示烃基)在NaOH的水溶液中能发生水解反应,如:
CH3CH2Cl+H2O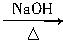 CH3CH2OH+HCl
CH3CH2OH+HCl
又如与 结构相似的醇不能被氧化成醛或羧酸。
结构相似的醇不能被氧化成醛或羧酸。
“智能型”大分子,在生物工程中有广泛的应用前景。PMAA就是一种“智能型”大分子,可用于生物制药中大分子和小分子的分离。
下列是以物质A为起始反应物合成PMAA的路线图: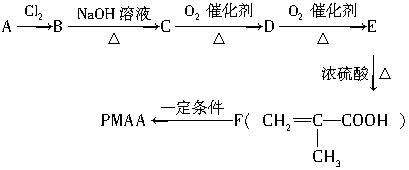
根据以上过程,完成下列问题:
(1)分别写出A和PMAA的结构简式:
A:_____________________,PMAA:_____________________。
(2)上述过程发生的反应类型分别有:_____________________。
(3)写出EF的化学方程式:__________________________________________。
羧酸酯RCOOR′在催化剂存在时可跟醇R″OH发生如下反应(R′、R″是两种不同的烃基):RCOOR′+R″OH RCOOR″+R′OH,此反应称为酯交换反应,常用于有机合成中。在合成维纶的过程中,有一个步骤是把聚乙酸乙烯酯
RCOOR″+R′OH,此反应称为酯交换反应,常用于有机合成中。在合成维纶的过程中,有一个步骤是把聚乙酸乙烯酯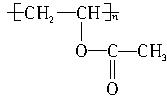 转化成聚乙烯醇,这一步就是用过量的甲醇进行酯交换反应来实现的。
转化成聚乙烯醇,这一步就是用过量的甲醇进行酯交换反应来实现的。
(1)反应中甲醇过量的原因是__________________________________________________。
(2)写出聚乙烯醇的结构简式:________________________________________________。
(3)写出聚乙酸乙烯酯与甲醇进行酯交换反应的化学方程式:______________________。
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子)制备BaCl2·2H2O,工艺流程如下:
已知:
①常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4
②BaCO3的相对分子质量是197;BaCl2·2H2O的相对分子质量是244
回答下列问题:
(1)SiCl4发生水解反应的化学方程式为_______________________________________
(2)用H2还原SiCl4蒸汽可制取纯度很高的硅,当反应中有1mol电子转移时吸收59KJ热量,则该反 应的热化学方程式为_____________________________________________
(3)加钡矿粉并调节pH=7的目的是① ,②
(4)过滤②后的滤液中Fe3+浓度为 (滤液温度25℃,Ksp[Fe(OH)3]=2.2×10-38)
(5)生成滤渣A的离子方程式__________________________________________
(6)列式计算出10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O的质量为多少吨?
乙二酸(H2C2O4)是一种重要的化工产品,可以使酸性高锰酸钾溶液褪色,其制备工艺流程如下: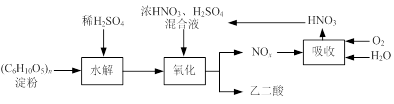
氧化时控制反应液温度为55~60℃,边搅拌边缓慢滴加浓HNO3、H2SO4混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
(1)检验氧化后的溶液中是否仍含有葡萄糖的实验方案为 。
(2)氧化时控制反应液温度为55~60℃的原因是 。
(3)若水解时淀粉利用率为80%,氧化时葡萄糖的利用率为80%,结晶时有10%的乙二酸遗留在溶液中。则30 kg淀粉可生产乙二酸的质量为 。
(4)生产中产生的NOx用氧气和水吸收后产生硝酸循环利用,若尾气NOx中n(NO2)︰n(NO)=2︰1,且NOx的吸收转化率为90%。计算:理论上,每生产9 kg乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克。(写出计算过程)
用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++ FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是_________,写出“还原”时反应Ⅱ的离子方程式:__________。
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7。计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)
| 离子 |
离子浓度(mol·L-1) |
|
| 还原前 |
还原后 |
|
| SO42- |
3.20 |
3.50 |
| Fe2+ |
0.15 |
|
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份。一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol/LK2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL。试确定莫尔盐的化学式(请给出计算过程)。
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图: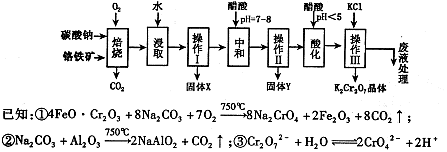
根据题意回答下列问题:
(1)固体X中主要含有 (填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用 (填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH <5,其目的是 。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、
、过滤、 、干燥。
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是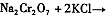
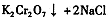 。该反应在溶液中能发生的理由是: 。
。该反应在溶液中能发生的理由是: 。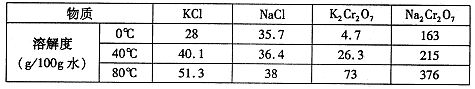
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量 (填写试剂)、溶解、过滤、再加入过量 (填写试剂)、……灼烧、冷却、称量,得干燥固体mg。计算祥品中氢氧化铝的质量分数为 (用含m、n的代数式表示)。
硅藻土是由硅藻死亡后的遗骸沉积形成的,主要成分是 SiO2和有机质,并含有少量的Al2O3、Fe2O3、MgO 等杂质。精制硅藻土因为吸附性强、化学性质稳定等特点被广泛应用。下图是生产精制硅藻土并获得Al(OH)3的工艺流程。
(1)粗硅藻土高温煅烧的目的是 。
(2)反应Ⅲ中生成Al(OH)3沉淀的化学方程式是 ;氢氧化铝常用作阻燃剂,其原因是 。
(3)实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解。
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液。
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤。
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70 ℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF)。
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol·L-1 NaOH的标准溶液滴定至终点,消耗NaOH标准溶液VmL。
①步骤1中高温灼烧实验所需的仪器除三角架、泥三角、酒精喷灯外还有 。
a.蒸发皿 b.表面皿 c.瓷坩埚 d.铁坩埚
②实验中使用塑料烧杯和塑料漏斗的原因是 。
③步骤3中采用饱和KCl溶液洗涤沉淀,其目的是 。
④步骤4中滴定终点的现象为 。
⑤样品中SiO2的质量分数可用公式“ ×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温锻烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单的表示如下: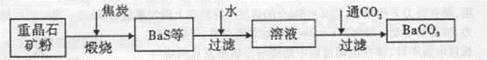
(1)若“煅烧”时产生一种有毒的还原性气体,则反应的化学方程式为______。
(2)工业上煅烧重晶石矿粉时,为使BaSO4得到充分的还原和维持及应所需的高温,应采取的措施是______。
a.加人过量的炭,同时通入空气 b.设法将生成的BaS及时移出
(3)在第一次过滤后洗涤,检验是否洗涤干净的试剂最好是______。
(4)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4 (s)+CO32-(aq) BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)
则:①在实验室将少量BaSO4固体全部转化为BaCO3的实验操作方法与步骤为______。
②与高温煅烧还原法相比,沉淀转化法的优点主要有______。
③已知:Ksp(BaCO3)=2.40×10-9,Ksp(BaSO4)=1.20×10-10。现欲用沉淀转化法将BaSO4转化为BaCO3,该反应的平衡常数为______。如用1.00 L 0. 210 mol • L-1 Na2CO3溶液处理,试计算BaSO4被转化的质量______(要有计算过程,结果保留3位有效数字)。
锶(Sr)为第五周期第II A族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,用工业碳酸锶粉末(含少量钡、铁的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。
已知:SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。请回答:
(1)操作①加快反应速率的措施有 (任写一种方法)。碳酸锶与盐酸反应的离子方程式为 。
(2)加入少量30% H2O2溶液的发生反应的离子方程式为 。
(3)步骤③中调节溶液pH至8—10,宜选用的试剂为_______(填序号):
A.氨水 B.氢氧化钠 C. 氢氧化锶粉末 D.碳酸钠晶体
所得滤渣的主要成分是Fe(OH)3和 (填化学式)。
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是 。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(5)若滤液中Ba2+ 浓度为1×10-5mol/L,依下表数据推算出滤液中Sr2+物质的量浓度不大于 mol/L。
| |
SrSO4 |
BaSO4 |
Sr(OH)2 |
| Ksp |
3.3×10—7 |
1.1×10—10 |
3.2×10—4 |
试题篮
()