工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
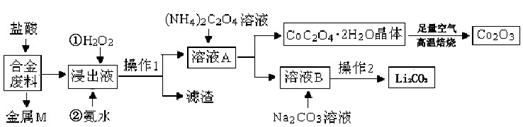
|
(1)金属M为 ,操作1为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。| 温度/℃ |
10 |
30 |
60 |
90 |
| 浓度/mol・L-1 |
0.21 |
0.17 |
0.14 |
0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 。
锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
Ⅰ、ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)②中使用的氧化剂最好是下列的 (选填字母代号)。
| A.Cl2 | B.浓HNO3 | C.KMnO4 | D.H2O2 |
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤 (选填①、②、③、⑤)。
(3)写出步骤④后产生滤渣3的化学式 。
(4)与Al相似,Zn也能溶于NaOH溶液。写出将Zn片和Cu片放入NaOH溶液中形成原电池的负极电极反应式: 。
Ⅱ、BaS溶液的制备:
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH1=-1473.2 kJ·mol-1
C(s)+ O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
Ba(s)+S(s)=BaS(s) ΔH3=-460 kJ·mol-1
(5)若煅烧还原的产物仅为BaS和CO,则其反应的热化学方程式为: 。
Ⅲ、制取锌钡白:
(6)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是 。
孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如下图。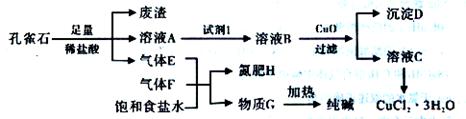
且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如下表所示。回答下列问题:
| 金属离子 |
Fe3+ |
Fe2+ |
Cu2+ |
|
| PH |
氢氧化物开始沉淀 |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀 |
3.2 |
9.0 |
6.7 |
(1)孔雀石研磨的目的是 。
(2)孔雀石的主要成分与足量稀硫酸反应的化学方程式为 。
(3)使用上图中“试剂1”的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用 (填选项序号)。
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离。则pH的范围为 。
(5)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中,其中,应先通入气体是 (填代号及对应物质的化学式)。
(6)由溶液C获得CuCl2·3H2O,需要经过 、 、过滤等操作。
(7)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O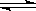 Cu(OH)2+2H+反应平衡常数 。
Cu(OH)2+2H+反应平衡常数 。
选考[化学---选修2:化学与技术]银、铜均属于重金属,从银铜合金废料中回收银并制备含铜化合物产品的工艺如图所示:
(1)熔炼时被氧化的元素是 ,酸浸时反应的离子方程式为 。为提高酸浸时铜元素的浸出率及浸出速率,酸浸前应对渣料进行处理,其处理方法是 。
(2)操作a是 ,固体B转化为CuAlO2的过程中,存在如下反应,请填写空白处:
CuO+ Al2O3 + ↑。
+ ↑。
(3)若残渣A中含有n mol Ag,将该残渣全部与足量的稀HNO3置于某容器中进行反应,写出反应的化学方程式 。为彻底消除污染,可将反应中产生的气体与V L(标准状况)空气混合通入水中,
则V至少为 L(设空气中氧气的体积分数为0.2)。
(4)已知2Cu+ 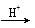 Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点 。
Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点 。
(5)假设粗银中的杂质只有少量的铜,利用电化学方法对其进行精炼,则粗银应与电源的 极相连,当两个电极上质量变化值相差30.4g时,则两个电极上银质量的变化值相差 g。
(12分)【化学——化学与技术】黄铜矿在我国储量丰富,主要产地集中在长江中下游地区、川滇地区、山西南部中条山地区、甘肃的河西走廊以及西藏高原等。这种铜矿石所含主要成分为CuFeS2,某企业以其为原料炼制精铜的工艺流程示意图如下:
请回答下列问题:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到l000℃,矿砂与空气反应生成冰铜(由Cu2S和FeS互相熔合而成)和大气污染物A,该过程中发生主要反应的化学方程式为_________________;A可用于海水提溴,在粗溴提纯环节中,A参与反应的化学方程式为__________________;利用反射炉中产生的矿渣可生产一种良好的无机高分子絮凝剂——聚硅酸铁,其具有净水作用。将下列各项中物质加入水中后,不具有类似聚硅酸铁的净水作用的是_____________(填下列序号字母)
a.明矾 b.硫酸镁 c.硫酸铁 d.硫酸铝
(2)冰铜所含铜元素的质量分数为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的部分Cu2S被氧化成Cu2O,生成的Cu2O再与Cu2S反应,得到粗铜,用一个反应的化学方程式表示利用冰铜生产粗铜的过程________,利用这种工艺生产2 t含铜量为98%的粗铜,至少需要铜元素含量为40%的冰铜_______t。
(3)以CuSO4溶液为电解液,电解精炼铜(粗铜中含Fe、Ag、Pt、Au等杂质)。下列说法中,正确的是______(填下列序号字母)。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.电解液中Cu2+向阳极移动
d.从阳极泥中可回收Ag、Pt、Au等金属
【化学选修-化学与技术】(15分)铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作______________剂。
(2)自然界中Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。写出过程中的离子方程式: 。
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为 。
②对滤液Ⅱ先加H2O2再调pH,加H2O2的目的是 ,调pH的目的是 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是 。
亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图:
己知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出ANClO2.3H2O
②
(1)吸收塔内发生反应的离子方程式为________。该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2若用二氧化氯和浓盐酸反应制取Cl2,当生成5molCl2时,通过还原反应制得氯气的质量为________g。
(2)从滤液中得到NaClO2.3H2O晶体的所需操作依次是________(填写序号)。
a.蒸馏
b.灼烧
c.过滤
d.冷却结晶
e.加热蒸发
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为_________(用化学式表示);
体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:________(填“前者大”“相等”或“后者大”)。
②是常用的沉淀剂。某工业污水中含有等浓度的Cu2+ 、Fe2+ 、Pb2+离子,滴加Na2S 溶液后首先析出的沉淀是________;当最后一种离子沉淀完全时(该离子浓度为l0 mol/L),此时体系中的S2-的浓度为____________.
mol/L),此时体系中的S2-的浓度为____________.
【化学-选修2:化学与技术】镁合金废料回收最常用的是熔炼法,其主要工艺流程为:
废料预处理→熔化→除铁→除气和除渣→铸造。
(1)废料预处理包括粉碎、除油污和油漆。
①粉碎方法有干态机械粉碎法和湿喷机械粉碎法,其中容易造成危险的方法是 ,理由是 。
②把油污和油漆一次性除去最适宜的方法是
A.用热碱洗涤,过滤
B.用有机溶剂溶解,过滤
C.加热气化除去
(2)镁合金在加热到935K时熔化,并不断向其中通入氩气做保护气。若液态镁与空气接触,不但会发生反应产生杂质,而且降低了镁的回收率。写出与空气的两个主要反应方程式 、 。
(3)向熔融镁中加入固体硼砂(B2O3)除铁,生成FeB2沉渣,写出有关的化学反应方程式 。
(4)镁合金除了含有铁之外,还含有少量铝。加入C2Cl6可以除去液态镁中的氢气,还能把铝转化为Al4C3沉渣:
C2Cl6→2C+3Cl2 (1)
3C+4Al→Al4C3 (2)
①除气除渣炉排出的污染性气体有 。
②如果1t镁合金中,铝占3.6‰,则除去铝最少需要加入C2Cl6 g。
选考[化学—选修化学与技术]
通常情况下,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,各国都在限制CO2的排量,同时也加强对CO2创新利用的研究。
(1)目前,推广用超临界CO2(介于气态和液态之间)代替氟利昂作致冷剂,这一做法对环境的积极意义是 。
(2)科学家为提取空气中的CO2,把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应使之变为可再生燃料甲醇。流程如图: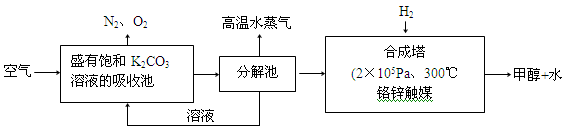
①分解池中反应的化学方程式为: 。
②合成塔中,若有4.4g CO2与足量H2恰好反应生成气态产物,放出4.947kJ的热量,写出该反应的热化学方程式: 。
(3)某同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积Ksp分别为4.96×10-9、2.58×10-9。他最好将空气通入足量的 溶液,实验时除测定温度、压强和空气的体积外,还需测定 。
【化学—选修2化学与技术】(15分)
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下: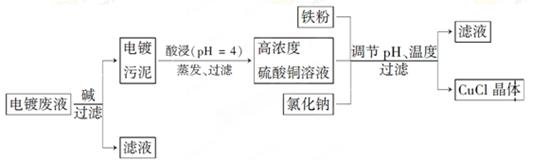
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。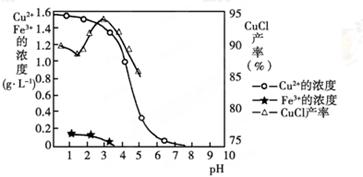
【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】
请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在_______左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是_____________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:______________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是_____________。
[选修2—化学与技术]金属钒被誉为“合金的维生素”,钒及其化合物在工业生产中有着广泛的应用。从废钒催化剂(主要成分有V2O5,VOSO4,K2SO4,SiO2等)中回收V2O5的生产流程图如下:
请回答:
(1)进行步骤①前,将废钒催化剂粉碎的目的是 。写出步骤①中发生氧化还原反应的离子方程式 。
(2)实验室中进行萃取分液操作时,用到的玻璃仪器有 。②③变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂)R2(SO4)n(水层)+2n HA(有机层) 2RAn(有机层) + n H2SO4(水层),为提高②中萃取百分率,应采取的措施是____ ;
2RAn(有机层) + n H2SO4(水层),为提高②中萃取百分率,应采取的措施是____ ;
(3)25°C时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
| 钒沉淀率% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
通过上表数据分析,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为______;
(4)在焙烧NH4VO3的过程中,固体质量的减少值(纵坐标)随温度变化的曲线如下图所示,则NH4VO3在分解过程中 。
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
(5)全钒液储能电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+ VO2++H2O+V3+,电池放电时正极的电极反应式为 。
VO2++H2O+V3+,电池放电时正极的电极反应式为 。
【化学—选修2化学与技术】(15分)
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下: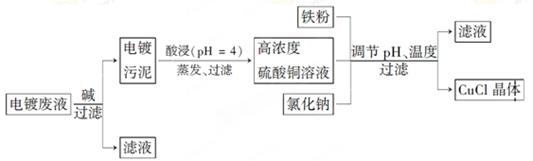
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。
【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】
请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在_______左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是_____________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:____________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是_____________。
下列相关工业制法的描述不正确的是
| A.电解熔融氯化钠制取金属钠 |
| B.电解熔融的Al(OH) 3制取金属铝 |
| C.用石英、纯碱、石灰石为原料制玻璃 |
| D.用焦炭在电炉中还原二氧化硅得到含杂质的粗硅 |
ZnO是电镀、涂料、有机合成等化学工业的重要原料。某课题组设计由含锌工业废料(含Fe、Cu、Mn等杂质)生产ZnO的工艺流程如下:
已知:黄钠铁矾在pH为1.5,温度为90℃时完全沉淀,且易于过滤。
2Cu +O2 +2H2SO4 == 2CuSO4+2H2O
(1)步骤①的浸取液里除含有Zn2+、Mn2+以外,还含有的金属离子有 、 ,所加试剂X为Na2SO4和_________的混合液。
(2)步骤②可进一步氧化除铁,还氧化除去了Mn2+,试写出相应的除去Mn2+的离子方程式_________________________,步骤③加入的试剂是_______,整个工艺流程中可以循环使用的试剂是_____________。
(3)步骤⑤中检验沉淀是否洗涤干净的操作方法是____________________________。
(4)步骤④碳化实际得到的是一种碱式碳酸锌[ZnCO3·xZn(OH)2·yH2O],取该样品7.18 g,充分灼烧后测得残留物质量为4.86 g,将所得气体通入足量澄清石灰水中,得到2.00 g沉淀,则此碱式碳酸锌的化学式是________________。
【化学—选修2:化学与技术】
近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 ;用这种方法处理SO2废气的优点是 。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下: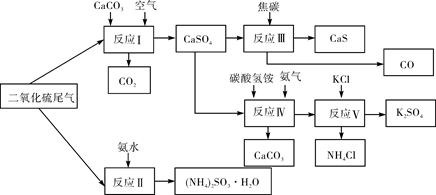
①生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 。
②下列有关说法正确的是 (填序号)。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应III中发生反应的化学方程式为CaSO4+4C CaS+4CO↑ CaS+4CO↑ |
| C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应V中的副产物氯化铵可用作氮肥 |
③反应V中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液做溶剂的原因是 。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式 。
试题篮
()