Ba(OH)2是重要的化工原料,工业上采用重晶石(主要成分为硫酸钡)和软锰矿(主要成分为二氧化锰,含有二氧化硅杂质)制备,同时得到碳酸锰等副产品。其工业流程如下:

已知:MnO2为两性氧化物,MnO为碱性氧化物。
(1)高温还原过程中,硫酸钡被碳还原为BaS,然后水浸得到。投料时煤炭的量相对要多其作用除了使硫酸钡充分反应外,还有 。
(2)氧化时反应还生成MnO和一种固体产物,则该反应的化学方程式为 ,氧化时控制MnO2与BaS的投料比在2~3之间,若投料比大于4,则Ba(OH)2的转化率明显降低,原因可能是
(3)酸化的离子反应方程式为 ,滤渣的主要成分为 。
(4)中和时通入氨气调节溶液的pH值,若pH值偏高,会造成碳酸锰不纯,原因是 。
某合作学习小组的同学拟用硼砂制取硼酸并测定硼酸样品的纯度。制备硼酸的实验流程如下:
(1)溶解硼砂时需要的玻璃仪器有:烧杯和 。
(2)用pH试纸测定溶液pH的操作方法为 。
(3)用盐酸酸化硼砂溶液生成硼酸的离子方程式为 。
(4)实验流程中缺少的步骤a、步骤b操作分别为 、 。
(5)硼酸酸性太弱不能用碱的标准溶液直接滴定,实验室常采用间接滴定法,其原理为:
滴定步骤为:
①滴定到终点时溶液颜色变化是 。
②若滴定到终点时消耗NaOH标准溶液22.00mL,则本次滴定测得的硼酸样品中硼酸的质量分数为 (假定杂质不反应)。
③若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,将导致测得的结果 (选填:“偏大”、“偏小”或“不变”)。
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2•6H2O的流程如下: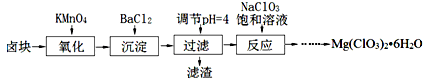
已知:
①卤块主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。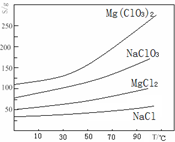
(1)“调节pH=4”可选用的试剂是 (填编号)。
①MgO ②CuO ③MgCO3 ④Mg
(2)加入BaCl2的目的是除去杂质离子,检验杂质离子已沉淀完全的方法是 。
(3)“滤渣”的主要成分为 。
(4)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3═===Mg(ClO3)2+2NaCl,再进一步制取Mg(ClO3)2•6H2O的实验步骤依次为:①蒸发、浓缩、结晶;② ;③ ;④过滤、洗涤、干燥。
(5)将产品先用水洗涤,再用无水乙醇清洗。无水乙醇的作用是 。
(6)产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量3.00g产品配成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol•L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol•L-1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:
Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
①写出步骤2中发生反应的离子方程式: 。
②产品中Mg(ClO3)2•6H2O的质量分数为 。
工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(已知Cd的金属活动性介于Zn和Fe之间)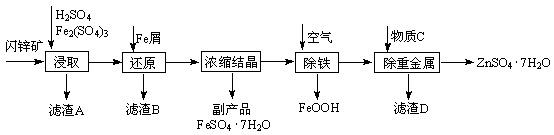
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。
该过程在空气入口处设计了一个类似淋浴喷头的装
置,其目的是 。
(4)置换法除去重金属离子Cd2+,所用物质C为 。
(5)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图所示。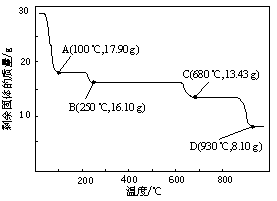
680℃时所得固体的化学式为 。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
(1)在第①步反应中,为加快反应速率,可采取的措施有 (任写一种),产生CO2气体的的方程式是 ;
(2)写出步骤②中所发生的离子方程式 ;
(3)如果蒸发得到的固体中,只含NaClO3和NaCl,为得到比较纯的NaClO3溶液,结合下面各物质的溶解度与温度的关系,
其基本操作是:将固体溶于适量水,通过 , ,便可得到较纯的NaClO3溶液。
(4)工业上也常用石墨做电极,电解酸化的MnSO4溶液来制MnO2,则阳极上所发生的离子方程式 。
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| |
Fe3+ |
Fe2+ |
Cu2+ |
| 氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀时的pH |
3.2 |
9.0 |
6.7 |
请回答下列问题。
(1)加入氧化剂的目的是 。
(2)最适合作氧化剂X的是 。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y是 。
(4)若不用物质Y而是直接用碱能不能达到目的? (填“能”或“不能”)。若能,不用回答;若不能,试解释原因: 。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是 。
(7)若向溶液Ⅱ中加入镁粉,产生的气体是 。试解释原因: 。
(8)FeCl3溶液具有净水作用的原因是 。
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下: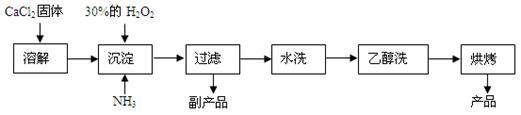
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是________;
(2)检验“水洗”是否合格的方法是________;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
①____________;②____________。
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知: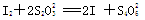 】
】
①CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是_________。
重铬酸钠(Na2Cr2O7•2H2O)俗称红矾钠,在工业上有广泛的用途。我国目前主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
①中涉及的主要反应有:
主反应: 4FeO·Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3 Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
Cr(OH)3 |
| 完全沉淀时溶液pH |
4.7 |
3.7 |
11.2 |
5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 。
(2)“③”中调节pH至4.7,目的是 。
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: 。
(4)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理可用还原法:
CrO42- Cr3+
Cr3+ Cr(OH)3。绿矾还原CrO42-的离子方程式为:
Cr(OH)3。绿矾还原CrO42-的离子方程式为:
。
用该方法处理10 m3 CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO4•7H2O,相对分子质量为278)的质量是 Kg(保留两位小数)。
步骤⑦的操作是 。为进一步得到较为纯净的红矾钠的操作是
三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化。制备三氯化铬的流程如下图所示:
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤,如何用简单方法判断其已洗涤干净? 。
(2)已知CCl4沸点为76.8℃,为保证稳定的CCl4气流,适宜的加热方式是 。
(3)用下图装置制备CrCl3时,
反应管中发生的主要反应为: Cr2O3+3CCl4==2CrCl3+3COCl2,则向三颈烧瓶中通入N2的作用为:
① ;
② 。
(4)样品中三氯化铬质量分数的测定:称取样品0.3000g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1g Na2O2,充分加热煮沸,适当稀释,然后加入过量2mol·L–1H2SO4至溶液呈强酸性,此时铬以Cr2O72–存在,再加入1.1g KI,加塞摇匀,充分反应后铬以Cr3+存在,于暗处静置5min后,加入1mL指示剂,用0.0250mol·L–1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL。(已知:2Na2S2O3+I2 == Na2S4O6+2NaI)
①滴定实验可选用的指示剂名称为 ,判定终点的现象是 ;若滴定时振荡不充分,刚看到局部变色就停止滴定,则会使样品中无水三氯化铬的质量分数的测量结果 (填“偏高”“偏低”或“无影响”)。
②加入Na2O2后要加热煮沸,其主要原因是 。
③加入KI时发生反应的离子方程式为 。
④样品中无水三氯化铬的质量分数为 。(结果保留一位小数)
(10分)以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如下:
回答下列问题:
(1)写出氧化步骤中发生的主要反应的离子方程式 。
(2)如何检验中和液中的杂质离子已完全除尽? 。
(3)固体NH4Al(SO4)2·12H2O[相对分子质量:453]在加热时,固体残留率随温度的变化如图所示。
633℃时剩余固体的成分化学式为 。
(4)综上分析,流程图中M的主要成分的化学式为 ,M可用一种物质吸收以实现循环利用,该物质的名称是 。
已知:硼镁矿主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
回答下列有关问题:
(1)硼砂中B的化合价为 ,将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,该反应的离子方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应原理为 Mg+H2O2+2H+===Mg2++2H2O, 则正极反应式为 。常温下,若起始电解质溶液pH=1,则当溶液pH=6时, (填“有”或“没有”)Mg(OH) 2沉淀析出。(已知Ksp[Mg(OH) 2]=5.6×10-12)。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020 g粗硼制成的BI3完全分解,生成的I2用0.30 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。该粗硼样品的纯度为__ __(提示:I2+2 ===2I-+
===2I-+ )(结果保留一位小数)。
)(结果保留一位小数)。
实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·H2O),过程如下:
请回答下列问题:
(1)写出过程①中FeS和O2、H2SO4反应的化学方程式: 。
(2)将过程②中产生的气体通入下列溶液中,溶液会腿色的是 。
| A.品红溶液 | B.紫色石蕊试液 | C.酸性高锰酸钾溶液 | D.溴水 |
(3)过程③中,需要加入的物质是 (化学式)。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有 。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是 。
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: 。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:
根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率__ _.
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强.
硼和铝位于同一主族,它们可以形成许多组成和性质类似的化合物。一种用硼镁矿(Mg2B2O5·H2O)制取单质硼的工艺流程图如下: 
结合流程图回答下列问题:
(1)溶液a、溶液b中溶质的化学式分别为 . 。
(2)写出步骤①的化学方程式 。
(3)写出步骤②的离子方程式 。
(4)步骤③中化学反应可以发生的原因是 。
(5)过硼酸钠晶体(NaBO3·4H2O)是一种优良的漂白剂,在70℃以上加热会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T2℃时所得晶体的化学式为 。 
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
(1)硫酸渣的成分中既能与酸又能与碱反应的是 ,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: 。
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是
(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀 |
2.7 |
3.8 |
7.5 |
9.4 |
| 完全沉淀 |
3.2 |
5.2 |
9.7 |
12.4 |
(3)滤渣A的主要成分为 ,滤液B含有的主要物质有 。
(4)如何证明洗涤环节充分洗净 。
(5)已知硫酸渣质量为a kg,假设铁红制备过程中铁元素损耗25%,最终得到铁红的质量为b kg,则原来硫酸渣中铁元素质量分数为 。(用题中所给数据列式并用最简整数比表示结果)
试题篮
()