从柑橘中炼制萜二烯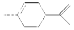 ,下列有关它的推测,不正确的是
,下列有关它的推测,不正确的是
| A.它不能使酸性高锰酸钾溶液褪色 |
| B.常温下为液态,难溶于水 |
| C.分子式为C10H16 |
| D.与过量的溴的CCl4溶液反应后产物如图 |
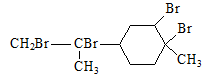
下列说法正确的是
| A.因海水中含有镁元素,故不需经过化学变化就可以得到金属镁 |
| B.从海水中可得到NaCl,电解熔融NaCl或其水溶液都可制得钠 |
| C.乙烯、丙烯、甲烷等主要化工基本原料都可以由石油分馏得到 |
| D.煤的干馏是化学变化,石油的分馏是物理变化 |
化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
I.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行右图实验(图中所用电极均为惰性电极): 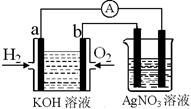
(1)对于氢氧燃料电池中,下列表达不正确的是________
| A.a电极是负极,OH-移向负极 |
| B.b电极的电极反应为:O2+2H2O+4e-=4OH- |
C.电池总反应式为:2H2+O2 2H2O 2H2O |
| D.电解质溶液的pH保持不变 |
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100mL、0.1mol·L—1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=________ (溶液体积变化忽略不计)
无水AlCl3易升华,可用作有机合成的催化剂等。工业 上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。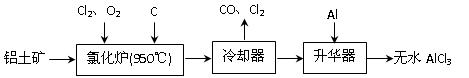
(1)氯化炉中Al2O3、C12和C反应的化学方程式为 ▲ 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 ▲ 。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是 ▲ 。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3) 的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式 ▲ 、 ▲ 。
②AlCl3产品的纯度为 ▲ 。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是 ▲ 。
(15分)我国是氧化铝生产大国,工业上每生产1 t氧化铝将排出1~2 t赤泥,赤泥大量堆积会对环境造成严重污染。赤泥中主要成分及含量:CaO约占46%、SiO2约占22%、Al2O3约占7%、Fe2O3约占11%、TiO2约占5%及少量其他物质。
⑴一种利用废弃赤泥的方法是将赤泥配成一定的液固比,作为一种吸收剂,吸收热电厂排放的含SO2的烟气,写出吸收SO2时可能发生的化学反应方程式______________________。
⑵为综合利用赤泥中的各种成分,某科研小组设计了如下工艺流程: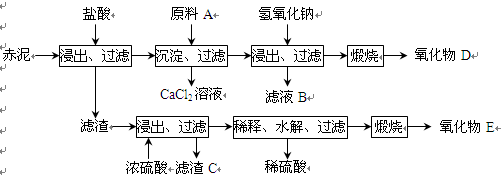
已知:TiO2不溶于稀盐酸、稀硫酸,能溶于浓硫酸生成TiOSO4(硫酸氧钛,易水解)。
①氧化物D的化学式是_____________,原料A最好是下列物质中的____________。
| A.氨水 | B.氢氧化钠 | C.生石灰 | D.双氧水 |
②写出上述工艺中投入氢氧化钠时反应的离子方程式:
______________________________________________________。
③写出上述工艺中稀释时发生水解反应的化学方程式:
______________________________________________________。
(15分)氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程: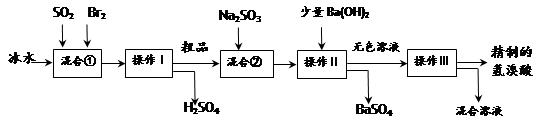
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为 。
(2)混合①中使用冰水的目的是 。
(3)操作Ⅱ和操作Ⅲ的名称分别是 、 。
操作Ⅲ一般适用于分离____________混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是 。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则 用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。
用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。
乙同学假设工业氢溴酸呈淡黄色是因为________,其用于证明该假设所用的试剂 。
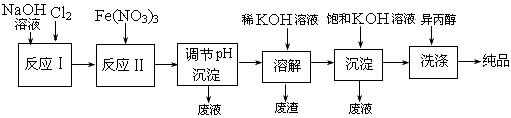
(12分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
| 湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示 :
:
|
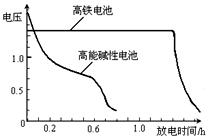
 ,上图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。
,上图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。
草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
a.将硫酸亚铁铵【(NH4)2Fe(SO4)2·6H2O】晶体溶于适量蒸馏水,加入适量稀硫酸酸化。
b.将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全。
c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干。试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加入少量稀硫酸,目的是 ▲ 。
(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如右图(TG%表示残留固体质量占原样品总质量的百分数)。
① 则A-B发生反应的化学方程式为: ▲ 。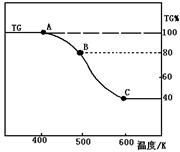
② 精确研究表明,B-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式: ▲ 、 ▲ ;
(3)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃.
的氩气中烧结6小时,即可制成硅酸亚铁锂。①合成硅酸
亚铁锂的化学方程式为: ▲ 。
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,
写出相应的电极反应式:
正极 ▲ 、负极 ▲ 。
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。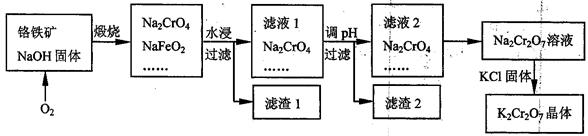 已知:①NaFeO2遇水强烈水解。②Cr2O72-+H2O
已知:①NaFeO2遇水强烈水解。②Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
请回答:
(1)K2Cr2O7中Cr元素的化合价是 。
(2)生成滤渣1中红褐色物质的反应的化学方程是 。
滤液1的成分除Na2CrO4外,还含有(填化学式) 。
(3)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是 。
(4)由滤液2转化为Na2Cr2O7溶液应采取的措施是 。
(5)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下:
(1)冷却过滤的目的是降低NaHSO4的 并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为 。SO2的作用是作 剂。
(3)循环使用的物质是 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是 。
(5)工业上用铂作阳极、铜或银作阴极电解盐酸也可制得高氯酸,在阳极区可得到20%的高氯酸。写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现) 。
MnSO4·H2O在工业、农业等方面有广泛的应用。
(一)制备:工业上用化工厂尾气中低浓度SO2还原MnO2矿制备MnSO4·H2O过程如下:
已知:常温时部分硫化物难溶盐的Ksp:CuS--6.3×10-36、PbS--1.0×10-28、NiS--2.0×10-26、MnS--2.5×10-10,请回答下列问题:
(1)生产中MnO2矿粉碎的目的是 。(2)除铁发生的离子反应方程式为 。
(3)除重金属离子后,若混合溶液中Cu2+、Pb2+、Ni2+的浓度均为1.0×10-5mol/L,则c(S2-)最大= mol/L。
(二):性质—热稳定性:MnSO4·H2O在1150℃高温下分解的产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是
(三)废水处理:工厂废水中主要污染为Mn2+和Cr6+,现研究铁屑用量和pH值对废水中铬、锰去除率的影响,(1)取100mL废水于250 mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图1所示。则在pH一定时,废水中铁屑用量为 时锰、铬去除率最好
(2)取100mL废水于250 mL三角瓶中,加入规定量的铁粉,调成不同的pH值。得到pH值对铬和锰去除率的影响如下图2所示。则在铁屑用量一定时,废水pH= 时锰、铬去除率最好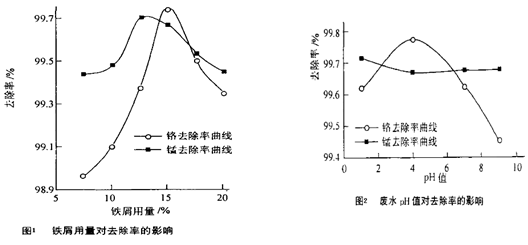
草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
a.将硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O晶体溶于适量蒸馏水,加入适量稀硫酸酸化。
b.将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全。
c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干。试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加入少量稀硫酸,目的是 。
(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。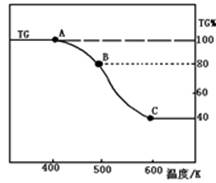
①则A-B发生反应的化学方程式为: 。
②精确研究表明,B-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式: 、
;
(3)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃. 的氩气中烧结6小时,即可制成硅酸亚铁锂。①合成硅酸亚铁锂的化学方程式为: 。
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,写出相应的电极反应式:
正极 、负极 。
试题篮
()