工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
| 钒沉淀率% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有 和 。
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。工业上回收废钒催化剂(含有V2O5、VOSO4、K2SO4、SiO2)中钒的主要流程如下:
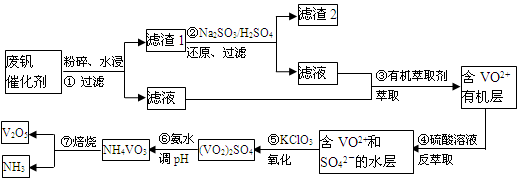
已知:(1)V2O5和NH4VO3均为难溶物,VOSO4和(VO2)2SO4均为易溶物。
(2) VO2++H2C2O4+H+ → VO2+ + CO2↑+ H2O
回答下列问题:
(1)步骤②的目的是 。
(2)步骤③的变化过程可简化为(HA表示有机萃取剂):
VOSO4 (水层)+ 2HA(有机层) VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是 。
VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是 。
(3)若ClO3-将被还原为Cl-,请写出骤⑤中发生反应的离子方程式为 。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定操作⑤后溶液中含钒量的步骤为:取10.0mL0.1mol/LH2C2O4溶液于锥形瓶中,加入指标剂,将待测液盛放在滴定管中,滴定到终点时,消耗待测液的体积为10.00mL,由此可知(VO2)2SO4溶液钒元素的含量为 g/L。
(5)V2O5可用金属(如Ca、Al)热还原法获得钒,则金属铝热还原制得钒的化学方程式为 。
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子),制备BaCl2 • 2H2O,
工艺流程如下:
已知:①常温下Fe3+、Mg2+ 完全沉淀的pH分别是3.4、12.4;
②BaCO3的相对分子质量是197; BaCl2 • 2H2O的相对分子质量是244;
(1)SiCl4发生水解反应的化学方程式 。
(2)氮化硅(Si3N4)是一种高温结构材料,粉末状的Si3N4可以在高温条件下由SiCl4 蒸
汽与NH3反应得到,请写出该反应的化学方程式 。
(3)加钡矿粉调节pH=7的作用是:
①使BaCO3转化为BaCl2
②_______________________________
(4)生成滤渣A的离子方程式________________________________________
(5)BaCl2滤液经____________________、______________________、过滤、洗涤,再经真空干燥后得到BaCl2 • 2H2O
(6)10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2 • 2H2O___________吨。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌,亚氯酸钠受热易分解。以氯酸钠(NaClO3)等为原料制备亚氯酸钠的工艺流程如下: 
(1)提高“反应1”反应速率的措施有 、 。(回答两点即可)
(2)“反应1” 的离子方程式是 。
(3)“反应2”的氧化剂是 ,该反应的化学方程式为 。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是 。
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
A.准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)
B.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用C mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V mL 。
(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为 。
②该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O ;
②Ksp(FeS)=6.3×10-18 ; Ksp(CuS)=6.3×10-36 ;Ksp(PbS)=2.4×10-28
(1)吸收塔内发生反应的离子方程式为 。该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2。若用二氧化氯和浓盐酸制取Cl2,当生成5 mol Cl2时,通过还原反应制得氯气的质量为 g。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a蒸馏;b灼烧;c过滤;d冷却结晶;e蒸发
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。
下表是 25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 |
HClO2 |
HF |
HCN |
H2S |
| Ka/mol•L-1 |
1×10-2 |
6.3×10-4 |
4.9×10-10 |
K1=9.1×10−8 K2=1.1×10−12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为 (用化学式表示);体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为: (填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是 ;当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为 。
电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:
用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程: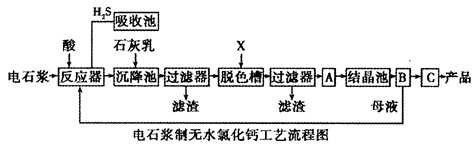
已知氯化钙晶体的化学式是:CaCl2·6H2O;H2S是一种酸性气体,且具有还原性。
(1)反应器中加入的酸应选用___________________。
(2)脱色槽中应加入的物质X是_______________;设备A的作用是______________;设备B的名称为________________;设备C的作用是____________________。
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是_____________。反应的化学方程式为_________________。
| A.水 | B.浓硫酸 | C.石灰乳 | D.硝酸 |
(4)将设备B中产生的母液重新引入反应器的目的是_______________________。
(5)氯碱工业电极方程式_____________________。
回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由锰粉制取MnO2的步骤如下图所示。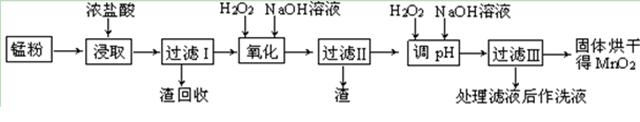
根据上图所示步骤并参考表格数据,回答下列问题。
| 物 质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Mn(OH)2 |
8.3 |
9.8 |
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等。MnO2与浓盐酸反应的离子方程方程式: _。
(2)酸浸时,浸出时间对锰浸出率的影响如下图所示,工业采用的是浸取60 min,其可能原因是 。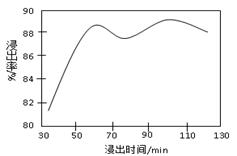
(3)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是 。
(4)过滤I所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是 。
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+ 氧化得到MnO2,反应的离于方程式为 。
(6)工业上利用KOH和MnO2为原料制取KMnO4。主要生产过程分两步进行:第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌以制取K2MnO4;第二步为电解K2MnO4的浓溶液制取KMnO4。
① 第一步反应的化学方程式为 。
② 电解K2MnO4的浓溶液时,电解池中阴极的实验现象为 。
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
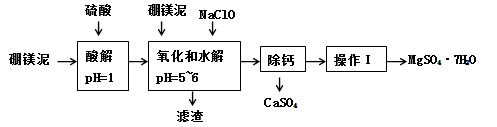
已知:某些氢氧化物沉淀的pH如下表所示:
| 氢氧化物 |
开始沉淀时的pH |
完全沉淀时的pH |
| Mg(OH)2 |
9.3 |
10.8 |
| Fe(OH)2 |
7.6 |
9.6 |
| Fe(OH)3 |
2.7 |
3.7 |
| Al(OH)3 |
3.7 |
4.7 |
根据题意回答第(1)~(6)题:
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:______、_____。
(2)加入的NaClO可与Mn2+反应:Mn2+ + ClO- + H2O = MnO2↓ + 2H+ + Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为 。
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(4)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤是蒸发浓缩, 。“操作I”是将滤液继续蒸发浓缩,冷却结晶, ,便得到了MgSO4·7H2O。
(5)实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为172.2 g,计算MgSO4·7H2O的产率为 (保留两位有效数字)。
(6)金属镁可用于自然水体中铁件的电化学防腐,完成下图防腐示意图,并作相应标注。
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下: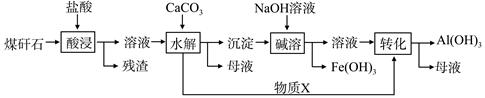
(1)“酸浸”过程中主要反应的离子方程式为_____________、_________________。
(2)“酸浸”时铝浸出率的影响因素可能有_____________、___________。(写出两个)
(3)物质X的化学式为___________。“碱溶”时反应的离子方程式为____________。
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得产品Al(OH) 3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是____________________。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因:_______________________。
硝酸铈铵[(NH4)2Ce(NO3)6]广泛应用于电子、催化工业,其合成路线如下:
(1)已知(NH4)2Ce(NO3)6受热易分解,某科研小组认为反应原理如下,请补充完整:(NH4)2Ce(NO3)6 CeO2·8OH + 8_____↑;CeO2·8OH
CeO2·8OH + 8_____↑;CeO2·8OH CeO2+ 4H2O↑+2O2↑。
CeO2+ 4H2O↑+2O2↑。
在空气中加热(NH4)2Ce(NO3)6,除固体颜色有变化外,还可观察到的现象是_________。
(2)步骤Ⅰ中,将Ce(NO3)3·6H2O配成溶液,保持pH到4~5,缓慢加入H2O2溶液搅拌混合均匀,再加入氨水调节溶液pH,得到Ce(OH)4沉淀。该过程中参加反应的氧化剂与还原剂物质的量之比为___________。
(3)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp=___________。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10—5mol·L-1,需调节pH为______以上。
(4)为了研究步骤Ⅲ的工艺条件,科研小组测定了(NH4)2Ce(NO3)6在不同温度、不同浓度硝酸中的溶解度,结果如图。从图中可得出三条主要规律:
① (NH4)2Ce(NO3)6在硝酸中的溶解度随温度升高而增大;
② _____________________________________________;
③ _____________________________________________。
(除标注外,每空2分,共8分)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是__ __。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是__ _。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:
____。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值。涉及反应如下(均未配平):
NiOOH+Fe2++H+——Ni2++Fe3++H2O
Fe2++MnO +H+——Fe3++Mn2++H2O
+H+——Fe3++Mn2++H2O
则x=____;y=__。
重铬酸钠(Na2Cr2O7•2H2O)俗称红矾钠,在工业上有广泛的用途。我国目前主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
①中涉及的主要反应有:
主反应: 4FeO·Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3  Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3  2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
Cr(OH)3 |
| 完全沉淀时溶液pH |
4.7 |
3.7 |
11.2 |
5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 。
(2)“③”中调节pH至4.7,目的是 。
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: 。
(4)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理可用还原法:
CrO42- Cr3+
Cr3+  Cr(OH)3。绿矾还原CrO42-的离子方程式为: 。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol/L的废水,至少需要绿矾(FeSO4•7H2O,相对分子质量为278)的质量是 Kg(保留两位小数)。
Cr(OH)3。绿矾还原CrO42-的离子方程式为: 。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol/L的废水,至少需要绿矾(FeSO4•7H2O,相对分子质量为278)的质量是 Kg(保留两位小数)。
磷酸铁锂(LiFePO4)被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下:
已知:H2TiO3是种难溶于水的物质。
(1)钛铁矿用浓硫酸处理之前,需要粉碎,其目的是 。
(2)TiO2+水解生成H2TiO3的离子方程式为 。
(3)加入NaClO发生反应的离子方程式为 。
(4)在实验中,从溶液中过滤出H2TiO3后,所得滤液浑浊,应如何操作 。
(5)为测定钛铁矿中铁的含量,某同学取经浓硫酸等处理的溶液(此时钛铁矿中的铁已全部转化为二价铁离子),采取KMnO4标准液滴定Fe2+的方法:(不考虑KMnO4与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果 (填“偏高”、“偏低”或“无影响”),滴定终点的现象是 。滴定分析时,称取a g钛铁矿,处理后,用c mol/L KMnO4标准液滴定,消耗V mL,则铁元素的质量分数的表达式为 。
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
(1)写出浸取过程中Cu2S溶解的离子方程式___________________________。
(2)回收S过程中温度控制在50~60 ℃之间,不宜过高或过低的原因是____________________、____________________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为______________________;向滤液M中加入(或通入)下列________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)保温除铁过程中加入CuO的目的是____________________;蒸发浓缩时,要用硝酸调节溶液的pH,其理由是______________________________。
[化学选修——2:化学与技术]我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、FeO、Fe2O3等。一种利用粉煤灰制取氧化铝、硫酸铁溶液、二氧化硅的工艺流程如下:

(1)操作i的名称为 。
(2)工业上若需加快粉煤灰与NaOH溶液反应的浸出速率,可采取的措施有 (写两点即可)。
(3)写出固体A溶解在稀硫酸中所得溶液与H2O2反应的离子方程式 。
(4)以上流程中可以循环利用的物质是 (填化学式)。
(5)某科研小组用硫酸作为浸取液,浸取粉煤灰中的铝元素和铁元素,在104℃用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为 h;铝的浸取率与的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在相同时,浸取率最高的是 (填化学式)。


(6)Al/AgO电池是一种新型安全电池,广泛用于军事领域,其电池总反应为:2Al + 3AgO + 2OH―+ 3H2O 2[Al(OH)4]―+ 3Ag,则该电池工作时正极的电极反应方程式为 ,若电池产生6mol电子转移,整体上分析电池负极消耗的OH―物质的量最终为 mol。
2[Al(OH)4]―+ 3Ag,则该电池工作时正极的电极反应方程式为 ,若电池产生6mol电子转移,整体上分析电池负极消耗的OH―物质的量最终为 mol。
试题篮
()