下列说法正确的是
| A.1869年门捷列夫提出元素周期律——元素的性质随着元素原子序数的递增而呈现周期性变化的规律 |
| B.煤在空气中强热得到焦炭、煤焦油、焦炉气、粗氨水等产品的过程叫煤的干馏 |
| C.再酿酒的过程中,葡萄糖可通过水解反应生成酒精 |
| D.工业生产玻璃、水泥、冶炼铁都需要用到石灰石为原料 |
将下列晶体熔化:NaOH、SiO2、CaO、CCl4,需要克服的微粒间的相互作用①共价键②离子键③分子间作用力,正确的顺序是
| A.②①②③ | B.①②②③ | C.②③②① | D.①①②③ |
氢气能在某黄绿色的单质气体中安静的燃烧,该单质所含元素位于元素周期表的
| A.第二周期ⅤA族 | B.第三周期ⅣA族 | C.第三周期ⅥA族 | D.第三周期ⅦA族 |
下列比较不能用元素周期律解释的是
| A.稳定性:HI﹤HBr﹤HCl﹤HF |
| B.元素非金属性:Si﹤P﹤S﹤Cl |
| C.沸点: 正丁烷>异丁烷>丙烷 |
| D.碱性:NaOH >Mg(OH)2>Al(OH)3 |
4种短周期元素X、Y、Z、W的原子序数依次增大,依据表中信息判断,下列说法不正确的是
| 元素 |
X |
Y |
Z |
W |
| 相关 信息 |
有两种常见的单 质,均有氧化性 |
短周期中原子半 径最大的元素 |
地壳中含量最多 的金属元素 |
最外层电子数是 电子层数的二倍 |
A.Y的单质燃烧火焰呈黄色
B.4种元素的简单离子半径最小的是Z
C.X与Y形成的化合物只含有离子键
D.Y、Z、W的最高价氧化物对应的水化物两两之间均能反应
同周期的X、Y、Z三种元素,已知最高价氧化物的水化物酸性由强到弱顺序为HXO4>H2YO4>H3ZO4,则下列判断错误的是( )
| A.原子序数:X>Y>Z | B.非金属性:X>Y>Z |
| C.原子半径:X>Y>Z | D.气态氢化物的稳定性:HX>H2Y>ZH3 |
氯化钠是一种重要的生活、生产必需品。下列表述中正确的是
A.NaCl的电子式为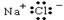 |
| B.NaCl的水溶液是强电解质 |
| C.23Na37Cl中质子数和中子数之比是8:7 |
| D.电解熔融氯化钠可得到氯气和金属钠 |
短周期元素W、X、Y、Z的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体。下列说法正确的是
| A.W的气态氢化物比X的稳定 |
| B.XY2与ZY2中的化学键类型相同 |
| C.离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) |
| D.Y的最高价氧化物对应水化物的酸性比W的强 |
一般情况下,前者无法决定后者的是
| A.原子核外电子排布——元素在周期表中的位置 |
| B.弱电解质的相对强弱——电离平衡常数的大小 |
| C.分子间作用力的大小——分子稳定性的高低 |
| D.物质内部储存的能量一一化学反应的热效应 |
试题篮
()