已知X、Y、Z、W四种元素是元素周期表中三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。试推断:
(1)X、Y、Z、W四种元素的符号:X 、Y 、Z 、W 。元素Z在周期表中的位置是______________________。
(2)由以上元素中的两种元素组成的化合物,溶于水后水溶液显碱性,该化合物的电子式分别为 、 (任写2种)。
(3)由X、Y、Z所形成的共价化合物(Y呈最高价)是 ,离子化合物是 。(均写化学式)
(4)由X和Y两种元素组成的18电子的分子为__________(写分子式),该分子中所有原子都已达到类似于稀有气体原子的稳定结构,则其结构式为__________。
(1)同一短周期元素的电子层数__________,但随着原子序数的递增,最外层电子数逐渐__________、原子半径逐渐___________,因此失电子能力逐渐__________,得电子能力逐渐_________,所以元素的金属性逐渐___________,非金属性逐渐___________。 第三周期非金属元素的最高价氧化物的水化物酸性由强到弱的顺序是________________________________________。
(2)日常生活中用于减缓食物腐败变质的措施和方法有__________________________、
________________________________、____________________________________等。
下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。 (2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
体心、顶点、面心),则该化合物的化学式为
(用对应的元素符号表示)。
(3)元素②的一种氢化物是重要的化工原料,
常把该氢化物的产量作为衡量石油化工发展水
平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。
请回答:表中的金属元素是 (填字母),其中化合价为+3价的是 (填字母);若A、B、C依次为同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是
。
已知X、Y、Z、W四种元素分布在元素周期表中的三个不同短周期元素里,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)写出X、Y的元素符号:X 、Y ;
(2)W在元素周期表中的位置是 ;Z的原子结构示意图
(3)由X、Y、Z所形成的离子化合物的化学式是 ,它与W的最高价氧化物的水化物的溶液反应时的离子方程式是 ;
(4)用电子式表示Y的氢化物的形成过程 。
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑧七种元素在周期表中的位置。
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
⑤ |
|
⑥ |
⑧ |
|
| 3 |
① |
③ |
④ |
|
|
|
⑦ |
|
| 4 |
② |
|
|
|
|
|
|
|
请回答:
(1)画出③的原子结构示意图
(2)在①、②、③三种元素的最高价氧化物对应水化物中,碱性最强的是
(填碱的化学式)。
(3)⑦、⑧两元素对应形成的氢化物中,最稳定的是 (填氢化物化学式)。
(4)写出⑤和⑥形成的三原子化合物的化学式
(5)写出①、④元素的最高价氧化物对应水化物之间反应生成的盐的化学式为: 。
36 g H2O与80 g D2O的物质的量之比是_ _____,分子中所含质子数之比是________,所含中子数之比是____ ___,它们分别与Na反应时,所放出气体体积之比(同条件下)是________,质量之比是________。
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题: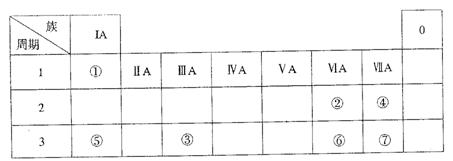
(1)④、⑤、⑦的原子半径由大到小的顺序为 。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 > 。
(3)①、②两种元素的原子按1:1组成的常见液态化合物的电子式为 。在酸性溶液中该物质能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。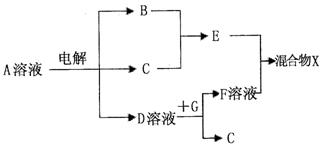
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法 。
③常温下,若电解l L 0.1 mol/L A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
④若上图中各步反应均为完全转化,则混合物x中含有的物质有 。
现有A、B、C、D、E五种短周期元素,已知他们的原子序数依次增大,元素A的原子只有一个电子层;又知元素A能分别与元素B、C、D形成电子总数相等的化合物分
子X、Y、Z,Y有刺激性气味,Z常温下为液态,元素E的单质的水溶液有漂白性。
请回答下列问题:
(1)元素E的单质的饱和溶液与石灰石反应后所得溶液的漂白性增强的原因是 ;
(2) 在锅炉水中加入C2A4,可以把锅炉表面的氧化铁还原为结构紧密的四氧化三铁保护层,C2A4被氧化,且反应中无污染物生成,写出反应的化学方程式(不必配平) ,1 mol C2A4参加反应转移电子的数目为 ,氧化产物的化学式为 ;
(3)化合物Y与元素C的最高正价氧化物的水化物按物质的量比为2:1完全反应后的水溶液呈 性(填“酸”“碱”或“中”),溶液中离子浓度由大到小的顺序为 ;
(4)用X、D2 和能传导O2-的的固体电解质组成的原电池中,负极的电极反应式为 。
(5)A、B、D三种元素可以形成最简式为B2A4D且有香味的有机物,该有机物在酸性条件下可以水解,生成含碳原子数相同的两种常见有机物,这两种有机物均可用作食品调味剂。则这种有香味的有机物在一定条件下水解的化学方程式是 。
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两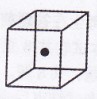
个选修模块的内容。请选择其中一题作答。若两题都做,则按A题评分。
A.微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有lO个电子;B溶
于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物
质混合后可得D和一种白色沉淀。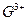 离子与Ar原子的电子层结构相同。请回答:
离子与Ar原子的电子层结构相同。请回答:
(1)基态G原子的外围电子排布式是 。在A、B、C这三种分子中,属于非极
性分子的有 (写化学式)。
(2)下列有关B的说法中正确的是 。(填字母)
a.在配合物中可作为配体 b.该分子的稳定性与氢键有关
c.分子由各原子最外层均为8 。的稳定结构
。的稳定结构
d.含1 mol B的液体中有3 mol氢键
(3)根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型
是 。
(4)构成C的中心原子可以形成多种单质,其中有一种为空间网状结
构,右图立方体中心的“●”表示该晶体中的一个原子,请在该
立方体的顶点上用“●”表示出与之紧邻的原子。
(5)光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中
不存在 。(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键
f.配位键 g.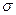 键 h.
键 h.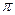 键
键
B.对氨基苯磺酸是制取某些染料和药物的重要中间体,可由苯胺磺化得到: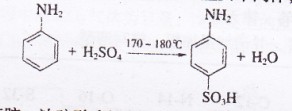
实验室可用苯胺、浓硫酸为原料,利用右图所示实验装置合成。
实验步骤如下:
①取一个250mL的仪器a,加入10mL苯胺及几粒沸石,
放人冷水中冷却,小心地加入18 mL浓硫酸。再分别
装上冷凝管、温度计等。
②将a置于油浴中缓慢加热至170`180℃,维持此温度约2.5 h。
③将反应产物冷却至约50℃后,倒入盛有100  ,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集
产品,晾干。(提示:100mL水在20℃时可溶解对氨基苯磺酸1.08 g,在100℃时可
溶解6.67 g)
(1)仪器a的名称是 。步骤①中加入沸石的作用是 。
(2)步骤②中采用油浴加热,下列说法正确的是 。(填字母)
A.便于控制温度 B.也可以改用水浴加热 C.温度计的水银球也可浸在油中
(3)步骤③用冷水洗涤的优点是 。
(4)步骤③和④均进行了抽滤操作,在抽滤完毕停止抽滤时,应注意先一二,然
后 。
(5)步骤④有时需重复进行多次,其目的是 。
X、Y、Z、W四种短周期元素在周期表中的位置关系如图:
I.若Z元素原子的最外层电子数是电子层数的2倍
(1)W在周期表中的位置为 。
(2)Y和Z可组成的化合物的化学式为 。
(3)写出铜和X的最高价氧化物水化物稀溶液反应的离子方程式 。
(4)W最高价氧化物水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28mol电子转移时,共产生9mol气体,写出该反应的化学方程式 。
II.若Y和z的核外电子数之和为22
(1)Y的气态氢化物电子式为 ,工业合成该物质的化学方程式为 。
(2)将X的最高价氧化物通人到苯酚钠溶液中,实验现象是 。
(3)X单质与W的最高价氧化物水化物的浓溶液反应,当电:子转移0.4mol时,产生气体的体积(标准状况下)是 。
A、B、C、D、E是核电荷数依次增大的5种短周期主族元素;原子半径按D、E、B、C、A顺序依次减小,B和E是同主族元素。
(1)下列推断正确的是
① A、B、E不可能在同一主族
② A、B、C可能在同一周期
③ C的最高价氧化物的水化物可能显碱性
④ C和D的单质可能生成离子化合物。
(2)若A与D同主族,B是形成化合物种类最多的元素,C原子的最外层电子数比A与B的最外层电子总数还多1。则A与C元素按原子个数比1:1形成的化合物F的电子式为 ;C与D形成的原子个数比为1:1的化合物19.5g与足量的水反应时,反应中所转移的电子的物质的量为 mol。
根据下表列出的前20号元素中部分元素的性质数据,完成下列题目。
| 性质\编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
| 原子半径 |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
| 最高正价 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
| 最低负价 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
注:原子半径的单位是埃(10-10m)。
(1)(1分) 元素⑦在周期表中的位置: ;
(2)(3分) 请写出编号为①、④、⑩的元素的名称:① 、④ 、⑩ ;
(3)(2分)写出元素③和⑤形成的三原子分子的结构式 、元素⑨的最高价氧化物对应的水化物的化学式 。
(4)(4分) 写出下列物质的电子式:元素⑦和⑧形成的化合物 、元素③与⑧及氢元素形成的碱 ;
(5)(2分) 现有三种物质:元素⑤的原子所形成的空间立体网状结构的物质A、元素③和⑤形成的有毒气体B、元素⑦和⑧形成的化合物C,请将A、B、C三种物质按熔点从高到低的顺序排列(用字母表示): 。
有A、B、C、D四种元素,它们均为主族元素,最外层电子数分别为1、4、6、7,原子序数大小为D<B<A<C。又知C元素的一种同位素原子核中有46个中子,它的最高价氧化物的式量与气态氢化物的式量之比值为1.56。
(1)A、B、C、D的元素符号分别是:
(2)写出A单质与水反应的离子方程式:
(3)写出D单质与水反应的化学方程式:
(4)写出A、B的最高价氧化物对应水化物反应的离子方程式: 。
W、X、Y、Z四种元素都位于短周期内,它们的原子序数依次递增。W原子核内仅有一个质子,X原子的电子总数与Z原子的最外层电子数相等,W原子与X原子的最外层电子数之和与Y原子的最外层电子数相等。Z原子L层电子数是K层电子数的3倍,且Z只能形成阴离子。由此推断它们的元素符号是:W____、X_____、Y______、Z________。已知W、Y、Z可组成一个化合物,其原子个数之比为4:2:3,该化合物的化学式是 。该化合物含有 。(填化学键类型)
试题篮
()