丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷( )脱氢制1-丁烯( )的热化学方程式如下:
① Δ H 1
已知:②
③
反应①的Δ H 1为________kJ·mol −1。图(a)是反应①平衡转化率与反应温度及压强的关系图, x_________0.1(填"大于"或"小于");欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
| A. |
升高温度 |
B. |
降低温度 |
C. |
增大压强 |
D. |
降低压强 |
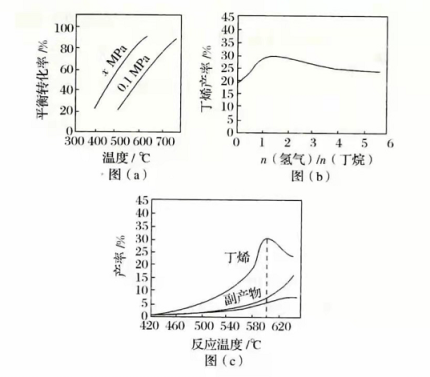
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中 n(氢气)/ n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
砷(As)是第四周期VA族元素,可以形成 、 、 、 等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图__________。
(2)工业上常将含砷废渣(主要成分为 )制成浆状,通入 氧化,生成 和单质硫。写出发生反应的化学方程式__________。该反应需要在加压下进行,原因是__________。
(3)已知:
则反应 的 __________。
(4)298K时,将 、 和 溶液混合,发生反应: 。溶液中 与反应时间(t)的关系如图所示。
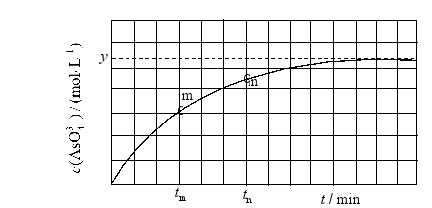
①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.
c. 不再变化
d.
② 时, __________ (填"大于"、"小于"或"等于")。
③ 时 __________ 时 (填"大于"、"小于"或"等于"),理由是__________。
④若平衡时溶液的 ,则该反应的平衡常数K为__________。
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为: 。下图为刚性容器中,进料浓度比 c(HCl) ∶ 分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
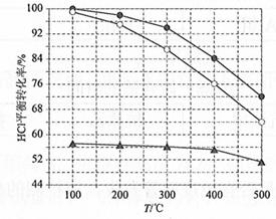
可知反应平衡常数 K(300℃)________ K(400℃)(填"大于"或"小于")。设HCl初始浓度为 , 根据进料浓度比 c(HCl)∶ c(O 2)=1∶1的数据计算 K(400℃)=________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比 c(HCl)∶ 过低、过高的不利影响分别是________。
(2)Deacon直接氧化法可按下列催化过程进行:
Δ
Δ
Δ
则 的 Δ H=________ 。
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
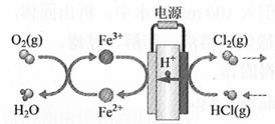
负极区发生的反应有________(写反应方程式)。电路中转移1 mol电子,需消耗氧气________L(标准状况)
环戊二烯(  )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知: 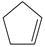 (g) =
(g) = 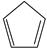 (g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
(g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
H 2(g)+ I 2(g) =2HI(g) Δ H 2=−11.0 kJ·mol −1 ②
对于反应:  (g)+ I 2(g) =
(g)+ I 2(g) = 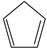 (g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(2)某温度下,等物质的量的碘和环戊烯( 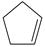 )在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
)在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
| A. |
通入惰性气体 |
B. |
提高温度 |
| C. |
增加环戊烯浓度 |
D. |
增加碘浓度 |
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。
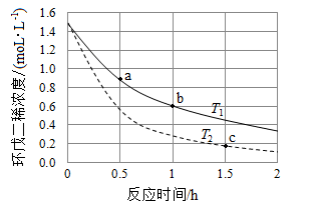
| A. |
T 1> T 2 |
| B. |
a点的反应速率小于c点的反应速率 |
| C. |
a点的正反应速率大于b点的逆反应速率 |
| D. |
b点时二聚体的浓度为0.45 mol·L −1 |
(4)环戊二烯可用于制备二茂铁(Fe(C 5H 5) 2结构简式为  ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
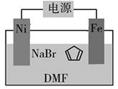

该电解池的阳极为________,总反应为________。电解制备需要在无水条件下进行,原因为________。
三氯氢硅(
)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1) 在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成 等,写出该反应的化学方程式________。
(2) 在催化剂作用下发生反应:
则反应 的 ________ 。
(3)对于反应 ,采用大孔弱碱性阴离子交换树脂催化剂,在 和 时 的转化率随时间变化的结果如图所示。
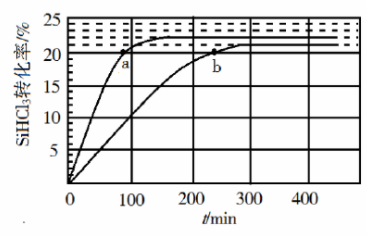
① 时反应的平衡转化率 α=________%。平衡常数 ________(保留2位小数)。
②在 下:要提高 转化率,可采取的措施是________;要缩短反应达到平衡的时间,可采取的措施有________、________。
③比较a、b处反应速率大小: ________ (填"大于""小于"或"等于")。反应速率 − , 、 分别为正、逆向反应速率常数, x为物质的量分数,计算a处 =________(保留1位小数)。
催化重整不仅可以得到合成气(CO和
)。还对温室气体的减排具有重要意义。回答下列问题:
(1) 催化重整反应为: 。
已知:
该催化重整反应的 ________ 。有利于提高 平衡转化率的条件是________(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2L的容器中加入 以及催化剂进行重整反应。达到平衡时 的转化率是50%,其平衡常数为________ 。
(2)反中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
| |
积碳反应
|
消碳反应
|
|
|
|
75 |
172 |
|
| 活化能/ |
催化剂X |
33 |
91 |
| 催化剂Y |
43 |
72 |
|
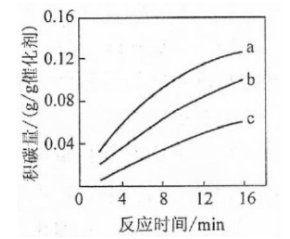
①由上表判断,催化剂X________Y(填"优于或劣于"),理由是________.在反应进料气组成,压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如右图所示,升高温度时,下列关于积碳反应,消碳反应的平衡常数(K)和速率(v)的叙述正确的是________(填标号)
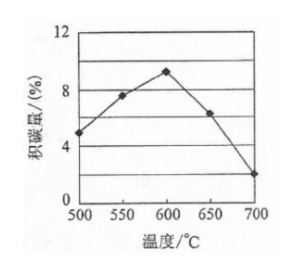
| A. | 、 均增加 |
| B. | 减小、 增加 |
| C. | 减小、 增加 |
| D. | 增加的倍数比 增加的倍数大 |
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为 (k为速率常数)。在 一定时,不同 下积碳量随时间的变化趋势如右图所示,则 、 、 从大到小的顺序为________
采用 为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用,回答下列问题:
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到 , 该反应的氧化产物是一种气体,其分子式为________。
(2)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时 (g)分解反应:
其中 二聚为 的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=x时, (g)完全分解):
| t/min |
0 |
40 |
80 |
160 |
260 |
1300 |
1700 |
∞ |
| P/kPa |
35.8 |
40.3 |
42.5 |
45.9 |
49.2 |
61.2 |
62.3 |
63.1 |
①已知:
则反应 的△H=________
②研究表明, (g)分解的反应速率 ,t=62min时,测得体系中 ,则此时的 =________ kPa,V=________ kPa, 。
③若提高反应温度至35℃,则 完全分解后体系压强 (35℃)________63.1kPa(填"大于""等于"或"小于"),原因是________。
④25℃时 反应的平衡常数 ________ kPa ( 为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应 ,R,A,Ogg提出如下反应历程:
第一步 快速平衡
第二步 慢反应
第三步 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是 __________(填标号)。
| A. | ν(第一步的逆反应P>ν(第二步反应) |
| B. | 反应的中间产物只有 |
| C. | 第二步中 与 的碰撞仅部分有效 |
| D. | 第三步反应活化能较高。 |
联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为________,其中氮的化合价为________.
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为________.
(3)①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=﹣1048.9kJ•mol﹣1
上述反应热效应之间的关系式为△H4=________,联氨和N2O4可作为火箭推进剂的主要原因为________.
(4) 联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离反应的平衡常数值为________(已知:N2H4+H+⇌N2H5+的K=8.7×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为________.
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是________.联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1kg的联氨可除去水中溶解的O2________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是________.
煤燃烧排放的烟含有 和 , 形成酸雨、污染大气,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝.回答下列问题:
(1) 的化学名称为________.
(2)在鼓泡反应器中通入含 、 的烟气,反应温度323K, 溶液浓度为 . 反应一段时间后溶液中离子浓度的分析结果如表.
| 离子 |
|
|
|
|
|
| c/ |
|
|
|
|
|
①写出 溶液脱硝过程中主要反应的离子方程式________.增加压强,NO的转化率________(填"提高"、"不变"或"降低").
②随着吸收反应的进行,吸收剂溶液的pH逐渐________(填"增大"、"不变"或"减小").
③由实验结果可知,脱硫反应速率________脱硝反应速率(填"大于"或"小于")原因是除了 和NO在烟气中初始浓度不同,还可能是________.
(3)在不同温度下, 溶液脱硫、脱硝的反应中 和NO的平衡分压 如图所示.
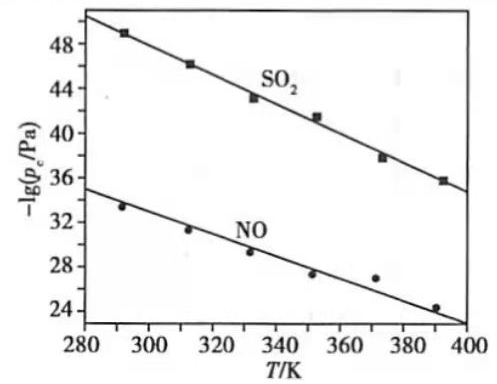
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______(填"增大"、"不变"或"减小").
②反应 的平衡常数K表达式为________.
(4)如果采用 、 替代 ,也能得到较好的烟气脱硫效果.
①从化学平衡原理分析, 相比 具有的优点是________.
②已知下列反应:
则反应 (aq)的△H=________.
探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=﹣49.5 kJ•mol﹣1
Ⅱ.CO(g)+2H2(g)⇌CH3OH(g)△H2=﹣90.4 kJ•mol﹣1
Ⅲ.CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3
回答下列问题:
(1)△H3= kJ•mol﹣1。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1mol CO2和3mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为bmol,此时H2O(g)的浓度为 mol•L﹣1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为 。
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。
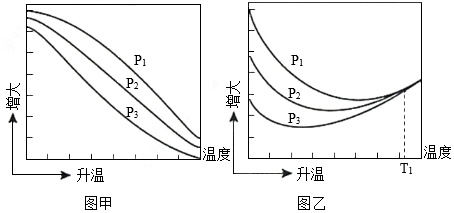
已知:CO2的平衡转化率 100%
CH3OH的平衡产率 100%
其中纵坐标表示CO2平衡转化率的是图 (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为 ;图乙中T1温度时,三条曲线几乎交于一点的原因是 。
(4 )为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为 (填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
天然气的主要成分为CH 4,一般还含有C 2H 6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C 2H 6(g)═C 2H 4(g)+H 2(g)△H 1,相关物质的燃烧热数据如下表所示:
| 物质 |
C 2H 6(g) |
C 2H 4(g) |
H 2(g) |
| 燃烧热△H/(kJ•mol ﹣ 1) |
﹣1560 |
﹣1411 |
﹣286 |
①△H 1= kJ•mol ﹣ 1。
②提高该反应平衡转化率的方法有 、 。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α.反应的平衡常数K p= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)高温下,甲烷生成乙烷的反应如下:2CH 4 C 2H 6+H 2.反应在初期阶段的速率方程为:r=k×c ,其中k为反应速率常数。
①设反应开始时的反应速率为r 1,甲烷的转化率为α时的反应速率为r 2,则r 2= r 1。
②对于处于初期阶段的该反应,下列说法正确的是 。
A.增加甲烷浓度,r增大
B.增加H 2浓度,r增大
C.乙烷的生成速率逐渐增大
D.降低反应温度,k减小
(3)CH 4和CO 2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
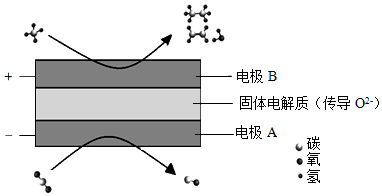
①阴极上的反应式为 。
②若生成的乙烯和乙烷的体积比为2:1,则消耗的CH 4和CO 2体积比为 。
试题篮
()