锌﹣空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为 。下列说法正确的是( )
| A. |
充电时,电解质溶液中K +向阳极移动 |
| B. |
充电时,电解质溶液中 逐渐减小 |
| C. |
放电时,负极反应为: |
| D. |
放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况) |
三室式电渗析法处理含 废水的原理如图所示,采用惰性电极, 均为离子交换膜,在直流电场的作用下,两膜中间的 和 可通过离子交换膜, 而两端隔室中离子被阻挡不能进入中间隔室。

下列叙述正确的是( )
| A. |
通电后中间隔室的 离子向正极迁移, 正极区溶液 增大 |
| B. |
该法在处理含 废水时可以得到 和 产品 |
| C. |
负极反应为 , 负极区溶液 降低 |
| D. |
当电路中通过 电子的电量时, 会有 的 生成 |
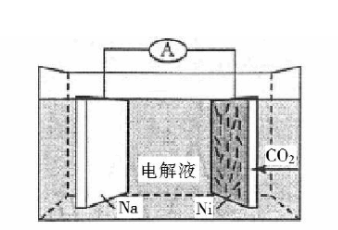
我国科学家研发了一种室温下"可呼吸"的
二次电池,将
溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:
 ,下列说法错误的是()
,下列说法错误的是()
| A. | 放电时, 向负极移动 |
B. | 充电时释放 ,放电时吸收 |
| C. | 放电时,正极反应为: |
D. | 充电时,正极反应为 |
电池是一种以海水为电解质溶液的水激活电池.下列叙述错误的是( )
A. 负极反应式为Mg﹣2e ﹣=Mg 2+
B. 正极反应式为Ag ++e ﹣=Ag
C. 电池放电时Cl ﹣由正极向负极迁移
D. 负极会发生副反应Mg+2H 2O=Mg(OH) 2+H 2↑
微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用如图装置处理有机废水(以含CH3COO﹣的溶液为例)。下列说法错误的是( )

A.负极反应为CH3COO﹣+2H2O﹣8e﹣═2CO2↑+7H+
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1mol电子时,模拟海水理论上除盐58.5g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2:1
下列实验操作不当的是 ( )
| A. | 用稀硫酸和锌粒制取 时,加几滴 溶液以加快反应速率 |
B. | 用标准HCl溶液滴定 溶液来测定其浓度,选择酚酞为指示剂 |
| C. | 用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有 |
D. | 常压蒸馏时,加入液体的体积不超过圆底烧瓶容积的三分之二 |
是一种重要的杀菌消毒剂, 也常用来漂白织物等, 其一种生产工艺如下:
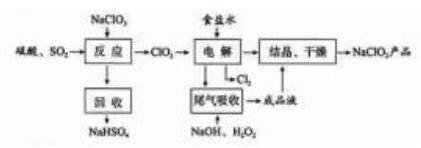
回答下列问题:
(1) 中 的化合价为_ 。
(2) 写出 "反应"步骤中生成 的化学方程式 。
(3) "电解"所用食盐水由粗盐水精制而成, 精制时,为除去 和 , 要加入的试剂分别为 、 。"电解" 中阴极反应的主要产物是_ 。
(4) "尾气吸收"是吸收 "电解"过程排出的少量 。此吸收反应中, 氧化剂与还原剂的
物质的量之比为 ,该反应中氧化产物 。
(5)"有效氯含量"可用来衡量含氯消毒剂的消毒能力, 其定义是:每克含氯消毒剂的氧化
能力相当于多少克 的氧化能力。 的有效氯含量为 。(计算结果保留两位小数)
环戊二烯(  )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知: 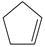 (g) =
(g) = 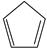 (g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
(g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
H 2(g)+ I 2(g) =2HI(g) Δ H 2=−11.0 kJ·mol −1 ②
对于反应:  (g)+ I 2(g) =
(g)+ I 2(g) = 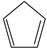 (g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(2)某温度下,等物质的量的碘和环戊烯( 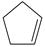 )在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
)在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
| A. |
通入惰性气体 |
B. |
提高温度 |
| C. |
增加环戊烯浓度 |
D. |
增加碘浓度 |
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。
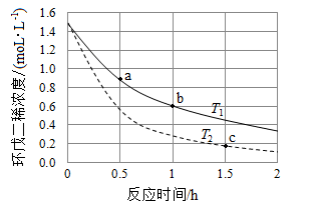
| A. |
T 1> T 2 |
| B. |
a点的反应速率小于c点的反应速率 |
| C. |
a点的正反应速率大于b点的逆反应速率 |
| D. |
b点时二聚体的浓度为0.45 mol·L −1 |
(4)环戊二烯可用于制备二茂铁(Fe(C 5H 5) 2结构简式为  ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
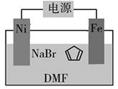

该电解池的阳极为________,总反应为________。电解制备需要在无水条件下进行,原因为________。
采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如图所示。忽略温度变化的影响,下列说法错误的是( )

A.阳极反应为2H2O﹣4e﹣═4H++O2↑
B.电解一段时间后,阳极室的pH未变
C.电解过程中,H+由a极区向b极区迁移
D.电解一段时间后,a极生成的O2与b极反应的O2等量
最近我国科学家设计了一种,CO₂+H₂S协同转化装置,实现对天然气中CO₂和H₂S的高效去除。示意图如右所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
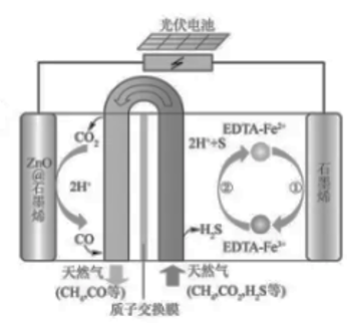
①E
②
该装置工作时,下列叙述错误的是( )
| A. | 阴极的电极反应: |
B. | 协同转化总反应:CO₂+H₂S=CO+H₂O+S |
| C. | 石墨烯上的电势比ZnO@石墨烯上的低 |
D. | 若采用 取代 , 溶液需为酸性 |
全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的 材料,电池反应为: 。下列说法错误的是( )
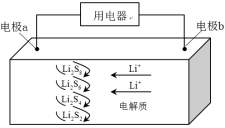
| A. |
电池工作时,正极可发生反应: |
| B. |
电池工作时,外电路中流过 电子,负极材料减重 |
| C. |
石墨烯的作用主要是提高电极a的导电性 |
| D. |
电池充电时间越长,电池中 的量越多 |
利用下列装置(夹持装置略)进行实验,能达到实验目的的是( )
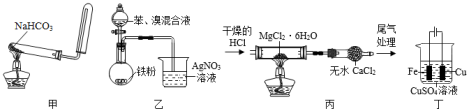
A.用甲装置制备并收集CO2
B.用乙装置制备溴苯并验证有HBr产生
C.用丙装置制备无水MgCl2
D.用丁装置在铁上镀铜
是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1) 的化学名称是________。
(2)利用" 氧化法"制备 工艺流程如下图所示:

"酸化反应"所得产物有 、 和 。"逐 "采用的方法是________。"滤液"中的溶质主要是________。"调pH"中发生反应的化学方程式为________。
(3) 也可采用"电解法"制备,装置如图所示。
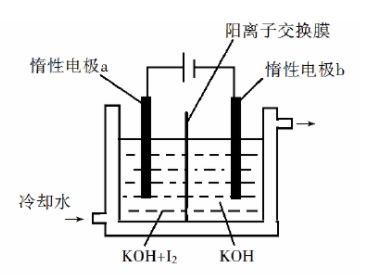
①写出电解时阴极的电极反应式________。
②电解过程中通过阳离子交换膜的离子主要为________,其迁移方向是________。
③与"电解法"相比," 氧化法"的主要不足之处有________(写出一点)。
支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极.下列有关表述不正确的是( )
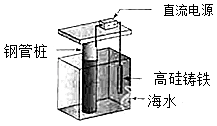
| A. |
通入保护电流使钢管桩表面腐蚀电流接近于零 |
| B. |
通电后外电路电子被强制从高硅铸铁流向钢管桩 |
| C. |
高硅铸铁的作用是作为损耗阳极材料和传递电流 |
| D. |
通入的保护电流应该根据环境条件变化进行调整 |
为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
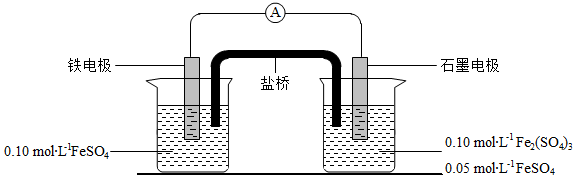
回答下列问题:
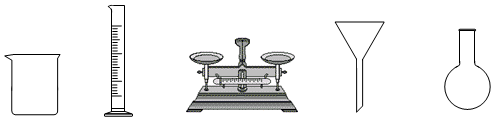
(1)由FeSO 4•7H 2O固体配制0.10mol•L ﹣ 1FeSO 4溶液,需要的仪器有药匙、玻璃棒、 (从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u ∞)应尽可能地相近。根据下表数据,盐桥中应选择 作为电解质。
| 阳离子 |
u ∞×10 8/(m 2•s ﹣ 1•V ﹣ 1) |
阴离子 |
u ∞×10 8/(m 2•s ﹣ 1•V ﹣ 1) |
| Li + |
4.07 |
HCO 3 ﹣ |
4.61 |
| Na + |
5.19 |
NO 3 ﹣ |
7.40 |
| Ca 2+ |
6.59 |
Cl ﹣ |
7.91 |
| K + |
7.62 |
SO 4 2 ﹣ |
8.27 |
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入 电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe 2+)增加了0.02mol•L ﹣ 1.石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe 2+)= 。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为 ,铁电极反应式为 。因此,验证了Fe 2+氧化性小于 ,还原性小于 。
(6)实验前需要对铁电极表面活化。在FeSO 4溶液中加入几滴Fe 2(SO 4) 3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是 。
试题篮
()