银锌碱性电池的电解质溶液为浓KOH溶液,放电时的总反应为:
Ag2O2+2Zn+4KOH+2H2O=2K2Zn( OH )4+2Ag下列有关该电池的说法不正确的是
| A.电池放电时,正极附近溶液的碱性增强 |
B.电池放电时,负极反应为 |
C.电池充电时,阳极反应为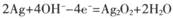 |
| D.充电时锌极与外电源正极相连 |
燃料电池能量利用率可高达80%,下列有关燃料电池的说法错误的是
| A.燃料电池的负极反应物是氢气、甲烷、乙醇等物质 |
| B.氢氧燃料电池常用于航天飞行器,产物为水经过处理之后可供宇航员使用 |
| C.乙醇燃料电池的电解质常用KOH,负极反应为C2H5OH-12e-=2CO2↑+3H2O |
| D.H2SO4作电解质,甲烷燃料电池的正极反应为O2+4H++4e-=2H2O |
LiFePO4可用于电动汽车。电池反应为:FePO4+Li LiFePO4,电解质为导电固体。下列有关LiFePO4电池的说法正确的是
LiFePO4,电解质为导电固体。下列有关LiFePO4电池的说法正确的是
| A.该电池可用水作电解质溶液 |
| B.充电时,电池内部的Li+向阳极移动 |
| C.充电阳极反应LiFePO4-e-=FePO4+Li+ |
| D.放电时正极材料的质量减少 |
某学生设计一水果电池:他把一铁钉和碳棒用导线连接好,然后将铁钉和碳棒平行插入一新鲜西红柿中,再在导线中接一个灵敏电流计.据此下列叙述正确的是
| A.电流计指针不会发生偏转 | B.金属铁会被腐蚀 |
| C.碳棒作负极 | D.铁表面有气体逸出 |
近年来,科学家研制了一种新型的乙醇电池,它用酸性电解质(H+)作溶剂。电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是
| A.乙醇在电池的负极上参加反应 |
| B.1mol CH3CH2OH被氧化转移6mol e- |
| C.随着反应的进行,正极附近的酸性减弱。 |
| D.电池正极的正极反应为4H++O2+4e-=2H2O |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )
| A.电池工作时,锌失去电子 |
| B.电池工作时,电子由正极通过外电路流向负极 |
| C.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| D.外电路中每通过O.2mol e-,锌的质量理论上减小6.5g |
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯( )中而形成的,电池总反应方程式为:
)中而形成的,电池总反应方程式为:
8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是 ( )
| A.电解质溶液中混入水,对电池反应无影响 |
| B.金属锂作电池的正极,石墨作电池的负极 |
| C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3 |
| D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1 |
汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:
PbO2 (s)+Pb(s)+2H2SO4(aq)===2PbSO4(s)+2H2O(l),根据此反应判断下列叙述中正确的是
| A.PbO2是电池的负极 |
| B.负极的电极反应式为:Pb(s)+SO42(aq)–2e – = PbSO4(s) |
| C.铅蓄电池属于一次电池 |
| D.电池放电时,溶液酸性增强 |
微生物燃料电池因具有原料广泛、操作条件温和、清洁高效和资源利用率高、无污染等特点而被人们所重视.以用葡萄糖作底物的燃料电池为例,其正负极反应式如下:
正极反应:6O2+24H++24e-12H2O
负极反应:C6H12O6+6H2O-24e-6CO2↑+24H+
则有关该电池的下列说法正确的是 ( )
| A.该电池的工作环境是高温条件 |
| B.作为负极的葡萄糖(C6H12O6)在变化中失去电子,被还原 |
| C.该电池的电解质溶液是强酸性溶液,如浓硫酸或硝酸等 |
| D.该电池的总反应为C6H12O6+6O26CO2+6H2O |
目前,人们正在研究开发一种高能电池---钠硫电池,它是以熔融的钠和硫为两极,以Na+导电的β′—Al2O3陶瓷作固体电解质,反应式如下:Na2Sx 2Na+xS,以下说法正确的是
2Na+xS,以下说法正确的是
| A.放电时,Na 作正极,S极发生还原反应 |
| B.充电时钠极与外电源的正极相连 |
| C.当用该电池电解AgNO3溶液时,阳极上产生标准状况下气体11.2L时,消耗金属钠2.3g |
| D.充电时,阳极发生的反应为:Sx2--2e— = xS |
下图为氢氧燃料电池的示意图:
⑴若以稀硫酸为电解液,则a极为___ _极。
⑵若以KOH溶液作电解液,则b极上的电极反应式为_______________________,放电一段时间后电解液的pH将________(填“变大”、“变小”或“不变”)。
肼(N2H4)一空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%-30%的KOH溶液。电池总反应为:N2H4+O2=N2↑+2H2O。下列关于该燃料电池工作时的说法正确的是( )
| A.溶液中阴离子物质的量基本不变 |
| B.正极的电极反应式是:O2+4H++4e―=2H2O |
| C.正极的电极反应式是:N2H4+4OH--4e=4H2O+N2↑ |
| D.溶液中阴离子向正极移动 |
根据铜锌原电池示意图,回答下列问题: 
(1)锌为 极,电极反应式为 ;铜为 极,电极反应为 ,原电池总离子反应式是 。
(2)若以该电池作为电源,以石墨碳棒为电极电解CuCl2溶液,在电池的工作过程中,Zn极质量变化了3.25g,则Cu极质量 (填“增加”、“不变”或“减少”);电子从电池的锌极沿导线流向电解池的 (填“阴极”或“阳极”,下同);在电解池中Cu2+向 移动,在该电极上析出铜的质量为 g。
氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH-,下列叙述不正确的是
| A.H2通入负极区 | B.O2通入正极 |
| C.正极发生氧化反应 | D.负极反应为2H2 + 4OH- - 4e- = 4H2O |
试题篮
()