一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A.反应CH4+H2O 3H2+CO,每消耗1molCH4转移12mol 电子 3H2+CO,每消耗1molCH4转移12mol 电子 |
| B.电极A上H2参与的电极反应为: H2+2OH--2e-=2H2O |
| C.电池工作时,CO32-向电极B移动 |
| D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量不减少,请回答下列问题:
(1)M电极的组成元素在周期表中的位置是_________________,电极名称是__________,加入乙醇的铂电极的电极反应式为________________,写出乙池中发生的化学反应的离子式________________;
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为____________L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的pH为________;
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量表示该反应的热化学方程式为________________;
(4)甲烷也是一种很好的清洁能源.蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体.甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol.356g“可燃冰”(若分子式为CH4•9H2O)释放的甲烷气体完全燃烧生成液态水.放出的热量为__________kJ;
科学家们在研制一种吸气式的锂—空气电池,工作时吸收空气中的氧气在多孔金制成的正极表面上反应。总反应可表示为2Li+O2 Li2O2下列有关说法正确的是
Li2O2下列有关说法正确的是
| A.充电时,多孔金制成的电极外接电源负极 |
| B.放电时,Li+从负极向正极移动 |
| C.放电时,吸收空气中22.4 L的O2,就有2 mol e-从电池负极流出 |
| D.该电池可使用含Li+的水溶液作电解质溶液 |
近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 ;用这种方法处理SO2废气的优点是 。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:

①生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 。
②下列有关说法正确的是 (填序号)。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应III中发生反应的化学方程式为CaSO4+4C  CaS+4CO↑ CaS+4CO↑ |
| C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应V中的副产物氯化铵可用作氮肥 |
③反应V中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率
超过90%,选用40%的乙二醇溶液做溶剂的原因是 。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式 。
锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-=C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料)
正极反应:Li1-xMO2+xLi++x e-=LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是( )
| A.锂离子电池放电时电池反应为LiMO2+C6Li1-x=C6Li+Li1-xMO2 |
| B.锂离子电池充电时电池内部Li+向负极移动 |
| C.锂离子电池放电时电池内部电流从负极流向正极 |
| D.锂离子电池充电时阳极反应为C6Li1-x+xLi++xe-=C6Li |
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2 + 11O2→ 4B2O3 + 2V2O5 。下列说法正确的是
| A.电极a为电池负极 |
| B.图中选择性透过膜只能让阳离子选择性透过 |
| C.电子由VB2极经KOH溶液流向a电极 |
| D.VB2极发生的电极反应为:2VB2 + 22OH−- 22e−→V2O5 + 2B2O3 + 11H2O |
(1)如图1是一种新燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。
①写出A极发生的电极反应式______________________;
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与____________极(填:“C”或“D”)相连;
③当消耗1.12L(标况下)CO时,粗铜电极理论上减少铜的质量不超过__________克。
(2)工业上,可用铁作阳极,电解KOH溶液制备K2FeO4。
①电解过程中,OH-向_________(填“阴”或“阳”)极移动,阳极的电极反应式为______________;
②若阳极有28gFe溶解,则阴极析出的气体在标准状况下的体积为___________L。
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+ AsO32-+I2+H2O”设计成原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是
AsO32-+I2+H2O”设计成原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是
| A.甲组操作时,微安表(G)指针发生偏转 |
| B.甲组操作时,溶液颜色变浅 |
| C.乙组操作时,C2做正极 |
| D.乙组操作时,C1上发生的电极反应为I2+2e-═2I- |
Ⅰ.(1)工业上合成氨的反应:N2(g)+3H2(g) 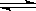 2NH3(g) ΔH=-92.60 kJ·mol-1。
2NH3(g) ΔH=-92.60 kJ·mol-1。
①恒温容积固定的密闭容器中发生反应:N2(g)+3H2(g) 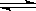 2NH3(g),下列说法能说明上述反应达到平衡状态的是____________。
2NH3(g),下列说法能说明上述反应达到平衡状态的是____________。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
 时间(h) 时间(h)物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
| N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
| H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
| NH3 |
0 |
0.20 |
n2 |
1.00 |
1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
Ⅱ.(1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径。目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g) ΔH>0。二甲醚气体的燃烧热为1 455 kJ·mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。下列有关叙述正确的是________。
CH3OCH3(g)+3H2O(g) ΔH>0。二甲醚气体的燃烧热为1 455 kJ·mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。下列有关叙述正确的是________。
A.二甲醚分子中含极性共价键
B.二甲醚作为汽车燃料不会产生污染物
C.二甲醚是非极性分子 D.表示二甲醚燃烧热的热化学方程式为CH3OCH3(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 455 kJ·mol-1
(2)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:正极为________(填“A电极”或“B电极”),H+移动方向为:由 到 (填A或B),写出A电极的电极反应式:___________。

我国科学家在天然气脱硫研究方面取得了新进展,利用右图装置可发生反应:H2S+O2 =H2O2 +S。
已知甲池中发生的反应为: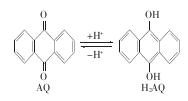 ,下列说法正确的是
,下列说法正确的是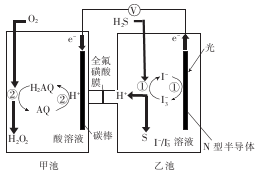
| A.该装置中电能转化为光能 |
| B.H+从甲池移向乙池 |
| C.甲池中碳棒上发生的电极反应为AQ+2H+-2e-=H2AQ |
| D.乙池溶液中发生的反应为H2S+I3- =3I- +S +2H+ |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4OH— =2CO32— + 6H2O,则下列说法错误的是
| A.放电时CH3OH参与反应的电极为正极 |
| B.充电时电解质溶液的pH逐渐增大 |
| C.放电时负极的电极反应为:CH3OH-6e-+8OH- = CO32— + 6H2O |
| D.充电时每生成1 mol CH3OH转移6 mol电子 |
一种石墨烯锂硫电池(2Li+S8=Li2S8)工作原理示意如图。下列有关该电池说法正确的是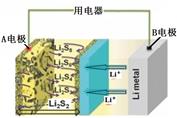
| A.B电极发生还原反应 |
| B.A电极上发生的一个电极反应为:2Li++S8+2e-=Li2S8 |
| C.每生成1mol Li2S8转移0.25mol电子 |
| D.电子从B电极经过外电路流向A电极,再经过电解质流回B电极 |
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)
 COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中固定体积容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中固定体积容器内各物质的浓度随时间变化的曲线。回答下列问题:
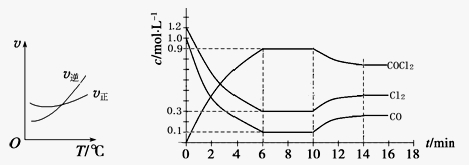
① 0~6 min内,反应的平均速率v(Cl2)= ;
②下列说法不能判断该反应达到化学平衡状态的是 。(填字母)
| A.体系中Cl2的转化率不变 |
| B.体系中气体的平均摩尔质量不再改变 |
| C.每消耗1mol CO的同时生成1mol COCl2 |
| D.混合气体密度不变 |
③随温度升高,该反应平衡常数变化的趋势是 ;(填“增大”、“减小”或“不变”)
④比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8) T(15)
(填“<”、“>”或“=”)。
⑤若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡
移动(填“向正反应方向”、“向逆反应方向”或“不”);
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ·mol-1;
H2O(g)=H2O(l)△H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:____________________________;
(3)如图所示,利用电化学原理将SO2转化为重要化工原料C
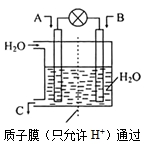
若A为SO2,B为O2,则负极的电极反应式为:________________________;
(1)对工业合成氨条件的探索一直是化学工业的重要课题,在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应,如下图(图中所示数据均为初始物理量)。t分钟后反应均达到平衡,生成NH3均为0.4mol(忽略水对压强的影响及氨气的溶解)。
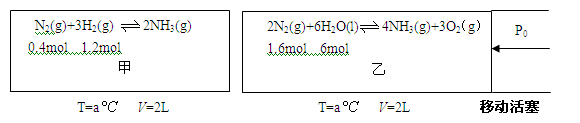
①判断甲容器中的反应达平衡的依据是 .(填写相应编号)
| A.压强不随时间改变 |
| B.气体的密度不随时间改变 |
| C.c(N2)不随时间改变 |
| D.单位时间内生成2molNH3的同时消耗1molN2 |
E.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下甲容器中反应的平衡常数K=
③该条件下,若向乙中继续加入0.2mol N2,达到新平衡时N2转化率= 。
(2)某甲醇(CH3OH)燃料电池原理如图1所示。
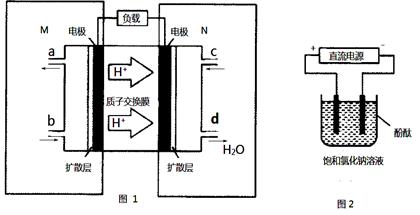
①M区发生反应的电极反应式为_______________________________.
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解池的总反应离子方程式为: . 假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化).
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
(1)氢氧燃料电池的能量转化主要形式是______________________,在导线中电子流动方向为_______(用a、b 表示)。
(2)负极反应式为 ___________________。
(3)电极表面镀铂粉的原因为___________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ.2Li+H2 2LiH
2LiH
Ⅱ.LiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是______________,反应Ⅱ中的氧化剂是_____________。
②用锂吸收224L(标准状况)H2,再由生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为__________mol。
试题篮
()