为充分利用海洋资源,研究人员发明海水电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列说法错误的是
| A.负极反应式: Ag+Cl-e-=AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na2Mn5O10是还原产物 |
| D.Cl-不断向电池的正极移动 |
大功率Al H2O2动力电池原理如图所示,下列说法不正确的是

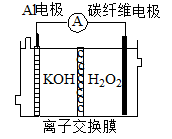
| A.电池组成中Al电极是负极 |
| B.OH-从碳纤维电极透过离子交换膜移向Al电极 |
| C.碳纤维电极的电极反应是H2O2+2e-+2H+=2H2O |
| D.该电池反应的离子方程式是2Al+3H2O2+2OH-=2Al(OH)4- |
用酸性甲醛燃料电池为电源进行电解的实验装置如图所示,下列说法中正确的是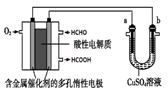
| A.当a、b都是铜做电极时,电解的总反应方程式为: 2CuSO4+2H2O 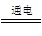 2H2SO4+2Cu+O2↑ 2H2SO4+2Cu+O2↑ |
| B.燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH— |
| C.当燃料电池消耗2.24L 甲醛气体时,电路中理论上转移2mole- |
| D.燃料电池工作时,负极反应为:HCHO+ H2O—2e-=HCOOH + 2H+ |
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
请回答下列有关含氮物质的问题:
(1)右图是1molNO2和1molCO反应生成CO2 和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_____________________________________;
恒温恒容条件下,不能说明该反应已达到平衡状态的是___(填序号)。
| A.容器内混合气体颜色不再变化 |
| B.容器内的压强保持不变 |
| C.v逆(NO2)=v正(NO) |
| D.容器内混合气体密度保持不变 |
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g) 2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。
2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。
该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应_______(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。总电池反应为N2H4+O2 = N2+2H2O。该电池放电时,负极的电极反应式是_________。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式_____________________________________。
肼可作为火箭发动机的燃料,与N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g) =N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g) = N2(g)+2H2O(g)ΔH2=-534.2 kJ·mol-1
(1)写出肼和N2O4反应的热化学方程式_________________________________;
(2)上述反应中氧化剂是 。
(3)火箭残骸中常现红棕色气体,当温度升高时,气体颜色变深,原因是存在如下反应:N2O4(g) 2NO2(g)
2NO2(g)
① 上述反应的ΔH 0(选填“>”或“<”)。
② 保持温度和体积不变向上述平衡体系中再充入一定量的N2O4,再次达到平衡时,混合气体中NO2的体积分数 (填“增大”、“ 减小”或“不变”),混合气体的颜色 (填“变深”或“变浅”)。
③一定温度下,将1 mol N2O4 充入一恒压密闭容器中发生上述反应,下列示意图正确且能说明反应达到平衡状态的是 。

④若在相同温度下,上述反应改在体积为10L的恒容密闭容器中进行,反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=_______mol·L-1·s-1。
(4)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为______。
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,
KOH作为电解质。下列关于该燃料电池的叙述不正确的是
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.负极发生的电极反应式为:N2H4+4OH--4e - =N2+4H2O |
| C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
| D.该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 |
1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才。现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟哈伯合成氨的工业化生产:N2(g)+3H2(g) 2NH3(g) △H<0
2NH3(g) △H<0
当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如下图所示。

回答下列问题:
(1)已知:①NH3(g)  NH3(g) △H1
NH3(g) △H1
②N2(g)+3H2(g) 2NH3(l) △H2
2NH3(l) △H2
则反应N2(g)+3H2(g) 2NH3(g)的△H= (用含△H1、△H2的代数式表示)。
2NH3(g)的△H= (用含△H1、△H2的代数式表示)。
(2)合成氨的平衡常数表达式为____ ,平衡时,M点NH3的体积分数为10%,则N2的转化率为 (保留两位有效数字)。
(3)X轴上a点的数值比b点 (填“大”或“小”)。上图中, Y轴表示 (填“温度”或“压强”),判断的理由是 。
(4)若将1mol N2和3mol H2分别投入起始容积为1L的密闭容器中,实验条件和平衡时的相关数据如下表所示:
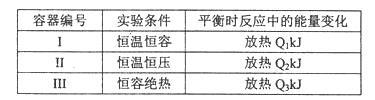
下列判断正确的是____。
| A.放出热量:Ql< Q2< △Hl | B.N2的转化率:I> III |
| C.平衡常数:II >I | D.达平衡时氨气的体积分数:I>II |
(5)常温下,向VmL amoI.L-l的稀硫酸溶液中滴加等体积bmol.L-l的氨水,恰好使混合溶液呈中性,此时溶液中c(NH4+)__c(SO42-)(填“>”、“<”或“=”)。
(6)利用氨气设计一种环保燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y203)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-。写出负极的电极反应式 。
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是
| A.X是电源的负极 |
| B.阴极的电极反应式是H2O+2e-==H2+O2- CO2+2e-==CO+O2- |
C.总反应可表示为H2O+CO2 H2+CO+O2 H2+CO+O2 |
| D.阴、阳两极生成的气体的物质的量之比是1∶1 |
一种熔融碳酸盐燃料电池原理示意如图。有关该电池的说法正确的是
A.反应CH4+H2O 3H2+CO,每消耗1 mol 3H2+CO,每消耗1 molCH4转移12 mol电子 |
| B.电极A上H2参与的电极反应: H2+2OH--2e-=2H2O |
| C.电池工作时,CO32-向电极B移动 |
| D.电极B上发生的电极反应:O2+2CO2+4e-=2CO32- |
近年来AIST报告正在研制一种“高容量、低成本”锂一铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu20+H2O= 2Cu十2Li++20H-,下列说法不正确的是
| A.放电时,Li+透过固体电解质向Cu极移动 |
| B.放电时,负极的电极反应式为Cu20+H2O+2e-=Cu+2OH- |
| C.通空气时,铜被腐蚀,表面产生Cu20 |
| D.整个反应过程中,铜相当于催化剂 |
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是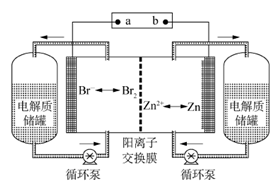
| A.充电时,阳离子通过交换膜移向装置右侧 |
| B.充电时,左侧与右侧的溴化锌溶液的浓度差将减小 |
| C.放电时装置发生的总反应为:Zn+Br2===ZnBr2 |
| D.阳离子交换膜可阻止Br2与Zn直接发生反应 |
汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO+2CO 2CO2+N2.在密闭容器中发生该反应时c(CO2)随温度(T)和时间(t)的变化曲线如图所示。
2CO2+N2.在密闭容器中发生该反应时c(CO2)随温度(T)和时间(t)的变化曲线如图所示。
① T1_(填“>”“<”或“=”)T2。
② 在T2温度下,0~2s内的平均反应速率v(N2)=________。
(2)NO2、O2和熔融NaNO3可形成燃料电池,其原理如图所示。通入O2的一极为_______(填“正极”或“负极”),该电池在使用过程中石墨I电极上生成N2O5,其电极反应式为_________。
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是________________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g
(2)在完全放电耗尽PbO2和Pb时,若按图连接
则电解一段时间后,在A电极上生成________、B电极上生成________,此时铅蓄电池的正负极的极性将________
一种碳纳米管能够吸附氢气,用这种材料吸氢后制备的二次电池(充放电电池)工作原理如下图所示,该电池的电解质为6 mol·L-1KOH溶液,下列说法中正确的是
| A.放电时K+移向碳电极 |
| B.放电时电池负极的电极反应为H2-2e-= 2H+ |
| C.充电时镍电极的电极反应为Ni(OH)2 + OH――e-= NiO(OH) + H2O |
| D.该电池充电时将碳电极与电源的正极相连,发生氧化反应 |
氨气是一种重要工业原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)=2NO(g) △ H=+180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=_________________________。
(2)工业合成氨气的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)①实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,画出反应及收集的简易装置实验室还可在 (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
② 常温下氨气极易溶于水,溶液可以导电。氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
③ 将相同体积、PH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序
为 。
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行图所示实验:(其中a、b均为碳棒)。如图所示:

右边Cu电极反应式是
a电极的电极反应式
试题篮
()