用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是
| A.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH- |
| B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
| D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e- + OH- ="NiOOH" + H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH -向正极移动 |
甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250 ℃ |
300 ℃ |
350 ℃ |
| K |
3.041 |
1.000 |
0.120 |
由表中数据判断ΔH________0 (填“>”、“=”或“<”),化学平衡常数表达式K= ;
(2)300 ℃时,在体积为2.0 L的密闭容器中通入2 mol CO和4 mol H2 ,经过20 s 达到平衡状态,
①计算20 s内CO的反应速率为 ,此时容器中甲醇的体积分数为 ;
②若向上述平衡体系中同时加入1mol CO,2mol H2 和1mol CH3OH气体,平衡移动情况是__________(填“向右”、“向左”或“不移动”),原因是 ;
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH1=-1277.0 kJ/mol
②2CO(g)+O2(g) = 2CO2(g) ΔH2=-566.0kJ/mol
③H2O(g) = H2O(l) ΔH3=-44 kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: ;
(4)甲醇,氧气可制作燃料电池,写出以氢氧化钾为电解质甲醇燃料电池负极反应式 ;如图,电解KI溶液制碘,在粗试管中加入饱和的KI溶液,然后再加入苯,插入一根石墨电极和一根铁电极,使用该燃料电池做电源,铁电极与 极(填正或负)相连接,通电一段时间后,断开电源,振荡试管,上层溶液为 色,当有1.27g 碘单质生成时,需要 g CH3OH。

铁路氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,
工作原理为 下列说法一定正确的是
下列说法一定正确的是
| A.电池充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B.电池放电时,负极的电极反应式为Fe2+-e-=Fe3+ |
| C.电池放电时,Cl-从负极穿过选择性透过膜移向正极 |
| D.电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1mol·L-1 |
据报道,我国拥有完全自主产权的氢氧燃料电池车已在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关该电池的叙述不正确的是
| A.正极反应式为:O2+2H2O+4e-===4OH- |
| B.工作一段时间后,电解液中KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D.该电池工作时每消耗1 mol O2,有2 mol电子转移 |
目前已研制出一种用磺酸类质子作溶剂的酸性乙醇电池,其效率比甲醇电池高出32倍,电池构造如图所示,电池反应式为:C2H5OH+3O2=2CO2+3H2O。下列关于该电池的说法正确的是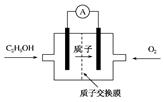
| A.通入乙醇的电极为该电池的正极 |
| B.放电过程中,电源内部的H+从正极区向负极区迁移 |
| C.该电池的正极反应为:4H++O2+4e—=2H2O |
| D.用该电池做电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2 mol C2H5OH,阴极产生标准状况下气体的体积为13.44 L |
质子交换膜燃料电池广受关注.
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气.
已知:C(s)+1/2O2(g)═CO(g) △H1=﹣110.35kJ·mol﹣1
2H2O(l)═2H2(g)+O2(g) △H2=+571.6kJ·mol﹣1
H2O(l)═H2O(g) △H3=+44.0kJ·mol﹣1
则C(s)+H2O(g)═CO(g)+H2(g) △H4= .
(2)燃料气(流速为1800mL·h﹣1;体积分数为50% H2,0.98% CO,1.64% O2,47.38% N2)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除.
①160℃、CuO/CeO2作催化剂时,CO优先氧化反应的化学方程式为 .
②灼烧草酸铈[Ce2(C2O4)3]制得CeO2的化学方程式为 .
③在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度变化如图1所示.加入 (填酸的化学式)的CuO/CeO2催化剂催化性能最好.催化剂为 - HIO3,120℃时,反应1h后CO的体积为 mL.
- HIO3,120℃时,反应1h后CO的体积为 mL.

(3)图2为甲酸质子交换膜燃料电池的结构示意图.该装置中 (填“a”或“b”)为电池的负极,负极的电极反应式为
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效 率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH 溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连 续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
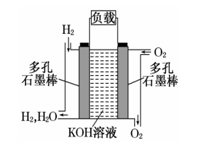
(1)写出氢氧燃料电池工作时负极反应方程式:
负极: 。
(2)为了获得氢 气,除了充分利用太阳能外,工业上利用石油产品与水在高温、催化剂作用下制取氢气.写出丙烷和 H2O 反应生成 H2 和 CO 的化学方程式:
(3)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为 : 电池总离子反应方程式为 。
(4)若将此燃料电池改进为直接以有机物 A 和氧气为原料进行工作,有机物 A 只含有 C、H、 O 三种元素,常用作有机合成的中间体。16.8 g 该有机物经燃烧生成 44.0 g CO2 和 14.4 g H2O ;质谱图表明其相对分子质量为 84,红外光谱分析表明 A 分子中含有 O—H 键和位于分子端的-C≡C-键,核磁共振氢谱有三个峰,峰面积为 6:1:1。A 的分子式是 A的结构简式是
甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成.电池的总反应式为2CH3OH+3O2+4OH-═2CO +6H2O.则下列说法正确的是
+6H2O.则下列说法正确的是
| A.电池放电时通入空气的电极为负极 |
| B.电池放电时负极的电极反应式为CH3OH-6e-+H2O═CO2↑+6H+ |
C.由于CO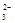 水解显碱性,电池放电时,电解质溶液的pH逐渐增大 水解显碱性,电池放电时,电解质溶液的pH逐渐增大 |
| D.电池放电时每消耗1molCH3OH转移6mol电子 |
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理______________________。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是_________(填序号)
A.Ba(NO3)2 B.BaCl2
C.Ba(OH)2 D.溶有NH3的BaCl2溶液
③已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是___________。
(2)电解法处理酸性含铬废水(主要含有Cr2O72-)时,在废水中加入适量NaCl,以铁板作阴、阳极,处理过程中存在如下反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+ 以Cr(OH)3形式除去,下列说法不正确的是______(填序号)
A.阳极反应为Fe-2e-═Fe2+
B.电解过程中溶液pH减小
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有2mol Cr2O72-被还原
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。右图是该燃料电池示意图,产生的X气体可直接排放到大气中,a电极作_________极(填“正”“负”“阴”或“阳”),其电极反应式为___________。

镁-空气电池的工作原理如右图所示。下列说法不正确的是( )

| A.工作一段时间后,c(Na+)变大 | B.电池工作时,OH-向a极移动 |
| C.气体X 中N2的百分含量与空气相同 | D.电池总反应为2Mg+O2+2H2O=2Mg(OH)2 |
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,下列叙述错误的是( )
| A.a为电池的正极 |
| B.电池充电反应为LiMn2O4=Li1-xMn2Ox+xLi |
| C.放电时,a极锂的化合价发生变化 |
| D.放电时,溶液中Li+从b向a迁移 |
科学家们在研制一种吸气式的锂—空气电池,工作时吸收空气中的氧气在多孔金制成的正极表面上反应。总反应可表示为2Li+O2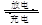 Li2O2下列有关说法正确的是
Li2O2下列有关说法正确的是
| A.充电时,多孔金制成的电极外接电源负极 |
| B.放电时,Li+从负极向正极移动 |
| C.放电时,吸收空气中22.4 L的O2,就有2 mol e-从电池负极流出 |
| D.该电池可使用含Li+的水溶液作电解质溶液 |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH+3O2 + 4OH-  2CO32-+6H2O,则下列说法错误的是
2CO32-+6H2O,则下列说法错误的是
| A.放电时CH3OH参与反应的电极为正极 |
| B.充电时电解质溶液的pH逐渐增大 |
| C.放电时负极的电极反应为:CH3OH - 6e- + 8OH-=CO32-+6H2O |
| D.充电时每生成1molCH3OH转移6mol电子 |
甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上通常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:
2H2(g)+CO(g) CH3OH(g) ΔH=-90.8kJ/mol。
CH3OH(g) ΔH=-90.8kJ/mol。
(1)该反应的平衡常数表达式为:K= ,如升高温度,K值将 (填:增大、减小或不变)。
(2)以下各项不能说明该反应达到平衡状态的是 .
A、混合气体的密度保持不变 B、甲醇的质量分数保持不变
C、CO的浓度保持不变 D、2v逆(H2)=v正(CH3OH)
(3)在2100C、2400C和2700C三种不同温度、2L恒容密闭容器中研究合成甲醇的规律。
上图是上述三种温度下不同的H2和C0的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是 。由起始达到a点所需时间为5min,则H2的反应速率 mol/(L·min)。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。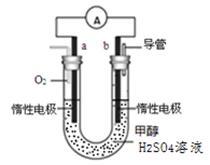
①该电池工作时,正极是 极(填“a”或 “b”);
②该电池负极反应的离子方程式为 。
试题篮
()