美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意如图,下列说法不正确的是
| A.a极为电池的负极 |
| B.电池工作时电流由b极沿导线经灯泡再到a极 |
| C.电池正极的电极反应为:2H++O2+4e-=H2O |
| D.电池工作时1mol乙醇被氧化时就有6mol电子转移 |
一种直接肼燃料电池的结构如图所示,下列说法正确的是
| A.a极为电池的正极 |
| B.电路中每转移6.02×1023个电子,则有1molNa+穿过膜向正极移动 |
| C.b极的电极反应式为H2O2+2e-=2OH- |
| D.用该电池电解饱和食盐水,当阳极生成2.24L(标准状况)Cl2时,消耗肼0.1mol |
质子交换膜燃料电池广受关注.
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气.
已知:C(s)+1/2O2(g)═CO(g) △H1=﹣110.35kJ·mol﹣1
2H2O(l)═2H2(g)+O2(g) △H2=+571.6kJ·mol﹣1
H2O(l)═H2O(g) △H3=+44.0kJ·mol﹣1
则C(s)+H2O(g)═CO(g)+H2(g) △H4= .
(2)燃料气(流速为1800mL·h﹣1;体积分数为50% H2,0.98% CO,1.64% O2,47.38% N2)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除.
①160℃、CuO/CeO2作催化剂时,CO优先氧化反应的化学方程式为 .
②灼烧草酸铈[Ce2(C2O4)3]制得CeO2的化学方程式为 .
③在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度变化如图1所示.加入 (填酸的化学式)的CuO/CeO2催化剂催化性能最好.催化剂为 - HIO3,120℃时,反应1h后CO的体积为 mL.
- HIO3,120℃时,反应1h后CO的体积为 mL.

(3)图2为甲酸质子交换膜燃料电池的结构示意图.该装置中 (填“a”或“b”)为电池的负极,负极的电极反应式为
新型NaBH4 / H2O2燃料电池(DBFC)的结构如下图所示(已知硼氢化钠中氢为-1价),有关该电池的说法正确的是
A.放电过程中,Na+从正极区向负极区迁移
B.电极B材料中含MnO2层,MnO2可增强导电性
C.电池负极区的电极反应:BH4-+8OH--8e-=BO2-+6H2O
D.电池反应中,每消耗1 L 6 mol/L H2O2溶液,理论上流过电路中的电子为6NA个
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e- + OH- ="NiOOH" + H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH- 向正极移动 |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
则有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e—+OH-=NiOOH+H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH- 向正极移动 |
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2- )在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是
| A.有O2参加反应的a极为电池的负极 |
| B.有H2参加反应的b极为电池的正极 |
| C.a极对应的电极反应式为O2 + 2H2O -4e = 4OH- |
| D.该电池的总反应方程式为:2H2+O2 = 2H2O |
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是
| A.电池放电时Na+从b极区移向a极区 |
| B.电极b采用MnO2,MnO2既作电极材料又有催化作用 |
| C.每消耗1mol H2O2,转移的电子为1mol |
| D.该电池的正极反应为:BH4-+8OH--8e-=BO2-+6H2O |
天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为CoO2+LiC6 LiCoO2+C6,下列说法正确的是
LiCoO2+C6,下列说法正确的是
| A.充电时,电池的阴极反应为LiC6-e-===Li++C6 |
| B.放电时,电池的正极反应为CoO2+Li++e-===LiCoO2 |
| C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质 |
| D.锂离子电池的比能量(单位质量释放的能量)低 |
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
| A.正极反应为Cl2+2e-=2Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.01 mol离子 |
人工光合系统装置(如图)可实现以CO2和H2O合成CH4。下列说法不正确的是
| A.该装置为原电池,且铜为正极 |
| B.电池工作时,H+向Cu电极移动 |
| C.GaN电极表面的电极反应式为:2H2O-4e-=O2+4H+ |
D.反应CO2+2H2O CH4+2O2中每消耗1molCO2转移4mole- CH4+2O2中每消耗1molCO2转移4mole- |
依据原电池原理,回答下列问题:
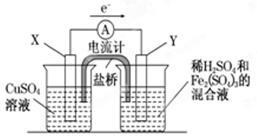
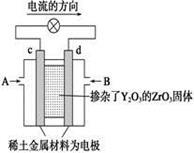
图(1) 图(2)
(1)图(1)是依据氧化还原反应:Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)设计的原电池装置。
①电极X的材料为是 ;电极Y的材料为是 。
②Y电极发生的电极反应式为: 。
(2)图(2)是使用固体电解质的燃料电池,装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e―→2O2-)。
① c电极的名称为 ②d电极上的电极反应式为 。
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
Ⅰ.将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度 /mol.L-1 |
4×10-5 |
6×10-5 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5的酸碱性,试样的pH=_________。
Ⅱ.NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
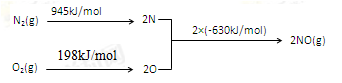
①N2(g)+O2(g) 2NO(g)△H=________。
2NO(g)△H=________。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式___。
2CO(g)═2C(s)+O2(g),已知该反应的△H>0,该设想不能实现,他的依据是_______。
Ⅲ.碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
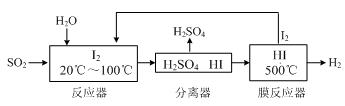
①用离子方程式表示反应器中发生的反应___________________________。
②用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池.电池充放电时的总反应为:Ni(OH)2+M  NiO(OH)+MH,电池放电时,负极电极反应式为:________________________。
NiO(OH)+MH,电池放电时,负极电极反应式为:________________________。
液流电池是一种新型可充电的高性能蓄电池,其工作原理如下图。两边电解液存储罐盛放的电解液分别是含有V3+、V2+的混合液和VO2+、VO2+酸性混合液,且两极电解液分开,各自循环。下列说法不正确的是( )

| A.充电时阴极的电极反应是V3++e-=V2+ |
| B.放电时,VO2+作氧化剂,在正极被还原,V2+做还原剂,在负极被氧化 |
| C.若离子交换膜为质子交换膜,充电时当有1mol e-发生转移时,左槽电解液的H+的物质的量增加了1mol |
| D.若离子交换膜为阴离子交换膜,放电时阴离子由左罐移向右罐 |
试题篮
()