(14分)汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图: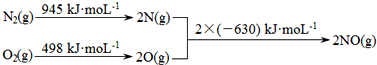
则该反应的热化学方程式为_____________________________。
(2)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx ="=" 2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下的N2体积_____________________L。
(3)一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,还可以用来合成很多有机物如甲醇等。在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇: CO(g)+2H2(g)  CH3OH(g);△H= -b kJ•mol-1
CH3OH(g);△H= -b kJ•mol-1
①该反应的平衡常数表达式为_____________________________。
②若容器容积不变,下列措施可增加甲醇产率的是______________
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1 mol CO和3 mol H2 |
③经测定不同温度下该反应的平衡常数如下:
| 温度(℃) |
250 |
300 |
350 |
| K |
2.041 |
0.270 |
0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO) =0.4 mol/L、c(H2)=0.4 mol/L、c(CH3OH)=0.8 mol·L-1, 则此时v正___________v逆(填>、<或=)。
(4)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池的正极反应式为_____________________________。电池工作时,固体电解质里的O2-向_______极移动。
(14分)某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
部分阳离子以氢氧化物形式沉淀时的pH如下: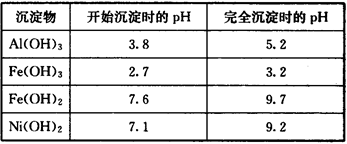
(1)“碱浸”过程中发生反应的离子方程式是 。
(2)“酸浸”时所加入的酸是 (填化学式)。
(3)加入H2O2时发生反应的离子方程式为 。
(4)操作b为调节溶液的pH,你认为pH的调控范围是 。
(5)产品晶体中有时会混有少量绿矾(FeS04·7H20),其原因可能是 。(写出一点即可)。
(6)NiSO4·7H2O可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为 。
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
(1)用CH4和02直接制备甲醇蒸气的热化学方程式为 。
(2)某温度下,向4 L恒容密闭容器中通人6 mol C02和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为 ,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为: ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:

①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 (填“3.5× 106 Pa” “4.O×106 Pa”或“5.0× 106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:
①通入a气体的电极是电池的 (填“正”或“负”)极,其电极反应式为 .
②常温下,用此电池以惰性电极电解O.5 L饱和食盐水(足量),若两极共生成气体1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为 (忽略溶液的体积变化)。
(10分)甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO(g)+ 2H2(g) CH3OH (g)
CH3OH (g)
(1)下图表示反应中能量的变化。
①此反应的ΔH=___________。
②已知CO2(g)+H2(g) CO(g)+H2O(g) △H=" +" 41.3kJ·mol-1,试写出由CO2和H2制取甲醇的热化学方程式 。
CO(g)+H2O(g) △H=" +" 41.3kJ·mol-1,试写出由CO2和H2制取甲醇的热化学方程式 。
(2)一种新型燃料电池,是用两根金属铂做电极插入KOH溶液中,然后向两极上分别通入CH3OH和O2。装置图如下所示:
①经测定,电子流动方向由b到a,则甲醇从_______(填“A”或“B”)口通入,该极的电极反应式为___________________。
②该电池工作一段时间后,正极附近的碱性____(填“增强”、“减弱”或“不变”)。
③用该电池电解(惰性电极)硝酸银溶液时,每消耗32 g CH3OH,生成银的质量为___ g。
2009年12月7日~18日在丹麦首都哥本哈根召开了世界气候大会,商讨《京都议定书》一期承诺到期后的后续方案,即2012年至2020年的全球减排协议,大会倡导“节能减排” 和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应: CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化: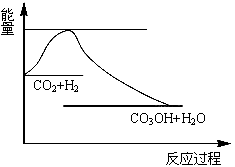
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),经测得CO2和CH3OH(g)的浓度随时间变化如图所示。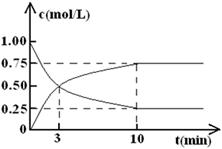
①从反应开始到平衡,CO2的平均反应速率v(CO2)= 。
②该反应的平衡常数表达式K= 。
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和3 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,写出该反应的热化学方程式:___________________________________________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入或通入的物质有__________ _____;其正极的电极反应式是:_____________________________________。
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2。下列说法中不正确的是
| A.该电池的负极反应为2SOCl2 + 4e— = S +SO2+4Cl— |
| B.该电池的负极反应为4Li = 4Li+ + 4e— |
| C.反应SOCl2 + H2O = SO2↑ + 2HCl↑为非氧化还原反应 |
| D.组装该电池必须在无水的条件下进行 |
氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为KOH,其正极反应为____________________________,
负极反应为__________________________________________;
(2)若电解质溶液为硫酸,其正极反应为______________________,负极反应为_________________;若在常温下转移2mol电子,可产生水质量为_________g。
(3)若用氢氧燃料电池做电源电解由NaCl和CuSO4组成的混合溶液,其中
c(Na+)=3c(Cu2+)=0.3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体。计算(写出计算过程)
此时氢氧燃料电池中消耗H2和O2的质量各是多少?(保留2位小数)
试题篮
()