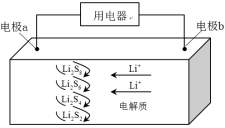
全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的 材料,电池反应为: 。下列说法错误的是( )
| A. |
电池工作时,正极可发生反应: |
| B. |
电池工作时,外电路中流过 电子,负极材料减重 |
| C. |
石墨烯的作用主要是提高电极a的导电性 |
| D. |
电池充电时间越长,电池中 的量越多 |
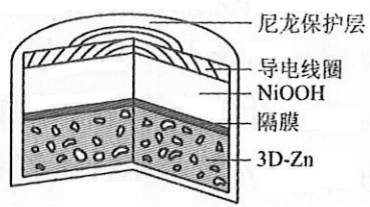
为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D−Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D−Zn-NiOOH二次电池,结构如下图所示。电池反应为
。下列说法错误的是( )
| A. |
三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高 |
| B. |
充电时阳极反应为 |
| C. |
放电时负极反应为 |
| D. |
放电过程中 通过隔膜从负极区移向正极区 |
一种可充电锂-空气电池如图所示。当电池放电时,
与
在多孔碳材料电极处生成
。下列说法正确的是( )
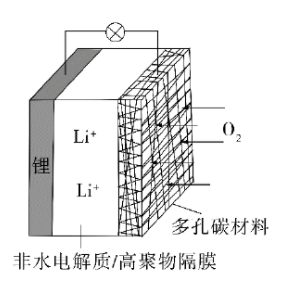
| A. | 放电时,多孔碳材料电极为负极 |
B. | 放电时,外电路电子由多孔碳材料电极流向锂电极 |
| C. | 充电时,电解质溶液中 向多孔碳材料区迁移 |
D. | 充电时,电池总反应为 |
我国科学家研发了一种室温下"可呼吸"的
二次电池,将
溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:
 ,下列说法错误的是()
,下列说法错误的是()
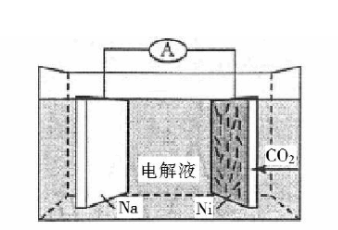
| A. | 放电时, 向负极移动 |
B. | 充电时释放 ,放电时吸收 |
| C. | 放电时,正极反应为: |
D. | 充电时,正极反应为 |
锌﹣空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为 。下列说法正确的是( )
| A. |
充电时,电解质溶液中K +向阳极移动 |
| B. |
充电时,电解质溶液中 逐渐减小 |
| C. |
放电时,负极反应为: |
| D. |
放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况) |
利用生物燃料电池原理研究室温下氨的合成,电池工作时
在电极与酶之间传递电子,示意图如下所示。下列说法错误的是( )

A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.阴极区,在氢化酶作用下发生反应
C.正极区,固氮酶为催化剂, 发生还原反应生成
D.电池工作时质子通过交换膜由负极区向正极区移动
某燃料电池主要构成要素如图所示,下列说法正确的是( )

A.电池可用于乙醛的制备
B.b电极为正极
C.电池工作时,a电极附近pH降低
D.a电极的反应式为O 2+4e ﹣﹣4H +═2H 2O
圣路易斯大学研制的新型乙醇燃料电池,用能传递质子(H+)的介质作溶剂,反应为C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是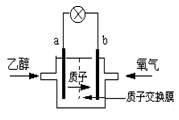
| A.a极为电池的正极 |
| B.电池正极的电极反应为4H++O2+4e-=2H2O |
| C.电池工作时电流由a极沿导线经灯泡再到b极 |
| D.电池工作时,1mol乙醇被氧化时就有6mol电子转移 |
获得“863”计划和中科院“百人计划”支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,已知电池总反应为2Al+3I2═2AlI3.下列说法不正确的是
| A.该电池负极的电极反应为:Al﹣3e﹣═Al3+ |
| B.电池工作时,溶液中的铝离子向正极移动 |
| C.该电池可能是一种可充电的二次电池 |
| D.消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多 |
甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成.电池的总反应式为2CH3OH+3O2+4OH-═2CO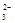 +6H2O.则下列说法正确的是
+6H2O.则下列说法正确的是
| A.电池放电时通入空气的电极为负极 |
| B.电池放电时负极的电极反应式为CH3OH-6e-+H2O═CO2↑+6H+ |
C.由于CO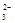 水解显碱性,电池放电时,电解质溶液的pH逐渐增大 水解显碱性,电池放电时,电解质溶液的pH逐渐增大 |
| D.电池放电时每消耗1molCH3OH转移6mol电子 |
锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是
| A.电池工作时,锌失去电子,电解液内部OH-向负极移动 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )

A.电极B为正极,纳米MnO2层的作用是提高原电池的工作效率
B.放电过程中,Na+从正极区向负极区迁移
C.电池负极的电极反应为:BH4-+8OH--8e-═BO2-+6H2O
D.在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为12mol
通过NOx传感器可监测NOx的含量,其工作原理示意图如下,下列说法不正确的是
| A.Pt电极是该装置的正极 |
| B.正极的电极反应式:O2 + 4e−+ 2H2O=4OH− |
| C.负极的电极反应式:NO−2e−+O2−=NO2 |
| D.固体电解质中O2−向负极移动 |
已知某碱性硼化钒(VB3)一空气电池工作时发生反应为:11O2+4VB2=2V2O5+4B2O3。以该电池作为电源,使用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
| A.VB2电极发生的电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+ |
| B.若B装置内的液体体积为400mL,则CuSO4溶液的物质的量浓度为0.025mol/L |
| C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生 |
| D.外电路中电子由a电极流向b电极 |
铅蓄电池是典型的可充电电池,在现代生活中有着广泛的应用,其充电、放电按下式进行: Pb+PbO2+2H2SO4  2PbSO4+2H2O, 有关该电池的说法正确的
2PbSO4+2H2O, 有关该电池的说法正确的
| A.放电时,电解质溶液的pH不断降低且正负极均有PbSO4生成 |
| B.放电时,每通过1mol电子,蓄电池就要消耗2mol H2SO4 |
| C.充电时,阳极反应:PbSO4 +2e- = Pb + SO42- |
| D.充电时,铅蓄电池的负极与外接电源的负极相连 |
试题篮
()