三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是( )
| A.可用铁作阳极材料 |
| B.电解过程中阳极附近溶液的pH升高 |
| C.阳极反应方程式为:4OH--4e-=2H2O+O2↑ |
| D.1 mol二价镍全部转化为三价镍时,外电路中通过了1 mol电子。 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说 法错误的是
法错误的是
| A.电池工作时,消耗金属锌 |
| B.电池工作时,MnO2被还原为Mn2O3 |
| C.电池正极的电极反应式为2MnO2+H2O+2e-==Mn2O3+2OH- |
| D.电解质KOH溶液浓度的大小对电池反应没有影响 |
某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是
| A.负极反应式为:H2+2OH-—2e-===2H2O |
| B.工作一段时间后,电解液中的KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2===2H2O |
| D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移 |
一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是( )
| A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e- |
| B.O2(g)+4H+(aq)+4e-=2H2O(1) |
| C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e- |
| D.O2(g)+2H2O(1)+4e-=4OH- |
一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷(C2H6)和氧气,有关此电池的推断错误的是
| A.通乙烷的电极为负极,电极反应为:C2H6+18OH――14e—=2CO32-+12H2O |
B.参加 反应的O2与C2H6的物质的量之比为7∶2 反应的O2与C2H6的物质的量之比为7∶2 |
| C.放电一段时间后,KOH的物质的量浓度将下降 |
D.放电一段时间后,正极 区附近溶液的pH减小 区附近溶液的pH减小 |
镍镉电池在通讯、交通及日常生活中有着广泛的应用,其工作原理可以表示为:Cd+2NiO(OH)+2H2O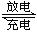 2Ni(OH)2+Cd(OH)
2Ni(OH)2+Cd(OH) 2以下说法中正确的是:( )
2以下说法中正确的是:( )
| A.以上反应是可逆反应 |
| B.放电时,镉为正极 |
| C.充电时电池上标有“+”号的电极连接电源负极 |
| D.以镍镉电池为电源,电解Na2CO3溶液,当收集到气体的总体积为33.6L(标况下)时,电池中转移了2mol电子 |
用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中正确的是( )
| A.铅蓄电池负极的反应式为:Pb → Pb2++ 2e - |
| B.铅蓄电池放电时,该电池两极质量均减少 |
| C.铅蓄电池充电时,A极应与外电源负极相连 |
| D.电解苦卤水时,a 电极首先放电的是Br- |
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是( )
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
| A.a电极是负极 |
| B.b电极上发生氧化反应 |
| C.氢氧燃料电池是一种具有应用前景的绿色电源 |
| D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
一种新型燃料电池,一极通入空气,另一极通入丁烷气 体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2—。下列对该燃料电池说法正确的是
体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2—。下列对该燃料电池说法正确的是
| A.在熔融电解质中,O2—由负极移向正极 |
| B.电池的总反应是:2C4H10 + 13O2===8CO2 + 10H2O |
| C.通入空气的一极是负极,电极反应为:O2 + 4e—===2O2— |
| D.通入丁烷的一极是正极,电极反应为:C4H10 + 26e— + 13O2—===4CO2 + 5H2O |
镁-H2O2酸性燃料电池采用海水作电解质,下列结论错误的是
| A.电池总反应为:Mg+H2O2=Mg(OH)2 | B.正极发生的电极反应为:H2O2+2H++2e-=2H2O |
| C.工作时,正极周围海水的pH增大 | D.电池工作时,溶液中的H+ 向正极移动 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应为Zn+2MnO2+H2O=Zn(OH)2+Mn2O3,下列说法错误的是( )
| A.电池工作时,锌失去电子 |
| B.电池正极反应式为: 2MnO2+H2O+2e-= Mn2O3+2OH- |
| C.电池工作时,负极附近pH降低 |
| D.正极是水电离出的H+得到电子 |
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
①每消耗1molCH4可以向外电路提供8mole-
②负极上CH4失去电子,电极反应式CH4+10OH--8e-=CO32-+7H2O
③负极上是O2获得 电子,电极反应式为 O2+2H2O+4e-=4OH-
电子,电极反应式为 O2+2H2O+4e-=4OH-
④电池放电后,溶液pH不断升高
| A.①② | B.①③ | C.①④ | D.③④ |
2010年1月8日,国防科工委举行新闻发布会,明确承认“中国具备制造航空母舰的能力”。初步计划,预计国产大功率镍氢动力电池将在制造航空母舰中发挥作用。常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零),惰性电极通常表示为LaNi5H6+6NiO(OH)放电充电LaNi5+6Ni(OH)2,下列说法不正确的是( )
| A.放电时储氢合金作负极 |
| B.充电时储氢合金作阴极 |
| C.1 mol LaNi5H6参加放电,能提供12 mol电子 |
| D.充电是将电能转化为化学能的过程 |
试题篮
()