用图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )

| A.可以用石墨作阳极,铁作阴极 |
| B.阳极的电极反应式为:2CN-+12OH-—10e-=N2↑+2CO32-+6H2O |
| C.阴极的电极反应式为: Cl-+2OH- +2e-=ClO-+H2O |
| D.除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O |
某种可充电聚合物锂离子电池放电时的反应为Li1﹣xCoO2 + LixC6 =" 6C" + LiCoO2,其工作原理示意图如图。下列说法不正确的是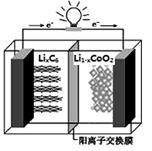
| A.放电时LixC6发生氧化反应 |
| B.充电时将电池的负极与外接电源的负极相连 |
| C.充电时,Li+通过阳离子交换膜从左向右移动 |
| D.放电时,电池的正极反应为:Li1﹣xCoO2+xLi++xe﹣═LiCoO2 |
一种新型燃料电池,一极通入空气,另一极通入丁烷气体,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料的说法正确的是 ( )
| A.在熔融电解质中,OH-由正极移向负极 |
| B.电池的总反应是:2C4H10+13O2→8CO2+10H2O |
| C.通入空气的一极是正极,电极反应为:O2+2H2O +4e-=4OH- |
| D.通入丁烷的一极是正极,电极反应为:C4H10+26 e-+13O2-=4 CO2↑+5 H2O |
在固态金属氧化物电解池中,高温电解H2O﹣CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
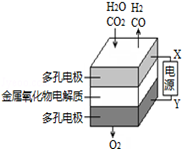
| A.X是电源的负极 |
| B.阴极的反应式是:H2O+2e﹣═H2+O2﹣,CO2+2e﹣═CO+O2﹣ |
C.总反应可表示为:H2O+CO2 H2+CO+O2 H2+CO+O2 |
| D.阴、阳两极生成的气体的物质的量之比是1:1 |
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A.反应CH4+H2O  3H2+CO,每消耗1molCH4转移12mol 电子 3H2+CO,每消耗1molCH4转移12mol 电子 |
| B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O |
| C.电池工作时,CO32-向电极B移动 |
| D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
微生物燃料电池(Microbial Fuel Cell,MFC)是一种利用微生物将有机物中的化学能直接转化成电能的装置。最早用于有机废水处理,下图是利用微生物燃料电池处理含甲醛废水的装置,其中3是质子交换膜,下列有关说法不正确的是
A.负极发生的反应为:HCHO-4e-+H2O=CO2+4H+
B.负极所在的左室中需保持厌氧环境
C.O2参与正极反应,发生还原反应
D.NH4+通过循环操作最终被转化成N2
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1﹣xCoO C6+LiCoO2。下列说法不正确的是
C6+LiCoO2。下列说法不正确的是
| A.据题意分析可知该隔膜只允许Li+通过,放电时 Li+从左边流向右边 |
| B.充电时,A为阴极,发生还原反应 |
| C.放电时,B为正极,电极反应式为:Li1﹣xCoO2+xLi++xe﹣=LiCoO2 |
| D.废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
为充分利用海洋资源,研究人员发明海水电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列说法错误的是
| A.负极反应式: Ag+Cl-e-=AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na2Mn5O10是还原产物 |
| D.Cl-不断向电池的正极移动 |
大功率Al H2O2动力电池原理如图所示,下列说法不正确的是

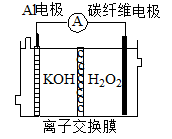
| A.电池组成中Al电极是负极 |
| B.OH-从碳纤维电极透过离子交换膜移向Al电极 |
| C.碳纤维电极的电极反应是H2O2+2e-+2H+=2H2O |
| D.该电池反应的离子方程式是2Al+3H2O2+2OH-=2Al(OH)4- |
用酸性甲醛燃料电池为电源进行电解的实验装置如图所示,下列说法中正确的是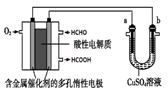
| A.当a、b都是铜做电极时,电解的总反应方程式为: 2CuSO4+2H2O  2H2SO4+2Cu+O2↑ 2H2SO4+2Cu+O2↑ |
| B.燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH— |
| C.当燃料电池消耗2.24L 甲醛气体时,电路中理论上转移2mole- |
| D.燃料电池工作时,负极反应为:HCHO+ H2O—2e-=HCOOH + 2H+ |
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,
KOH作为电解质。下列关于该燃料电池的叙述不正确的是
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.负极发生的电极反应式为:N2H4+4OH--4e - =N2+4H2O |
| C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
| D.该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 |
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是
| A.X是电源的负极 |
| B.阴极的电极反应式是H2O+2e-==H2+O2- CO2+2e-==CO+O2- |
C.总反应可表示为H2O+CO2 H2+CO+O2 H2+CO+O2 |
| D.阴、阳两极生成的气体的物质的量之比是1∶1 |
一种熔融碳酸盐燃料电池原理示意如图。有关该电池的说法正确的是
A.反应CH4+H2O 3H2+CO,每消耗1 mol 3H2+CO,每消耗1 molCH4转移12 mol电子 |
| B.电极A上H2参与的电极反应: H2+2OH--2e-=2H2O |
| C.电池工作时,CO32-向电极B移动 |
| D.电极B上发生的电极反应:O2+2CO2+4e-=2CO32- |
近年来AIST报告正在研制一种“高容量、低成本”锂一铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu20+H2O= 2Cu十2Li++20H-,下列说法不正确的是
| A.放电时,Li+透过固体电解质向Cu极移动 |
| B.放电时,负极的电极反应式为Cu20+H2O+2e-=Cu+2OH- |
| C.通空气时,铜被腐蚀,表面产生Cu20 |
| D.整个反应过程中,铜相当于催化剂 |
试题篮
()