镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
则有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e—+OH-=NiOOH+H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH- 向正极移动 |
如图是一种可充电的锂离子电池充、放电的工作示意图。放电时该电池的电极反应式为:负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)正极:Li1-xMnO2+xLi++x e-=LiMnO2(LiMnO2表示含锂原子的MnO2)下列有关说法正确的是
A.该电池的反应式为: |
| B.K与M相接时,A是阳极,发生氧化反应 |
| C.K与N相接时,Li+由A极区迁移到B极区 |
| D.在整个充电或放电过程中都只存在一种形式的能量转化 |
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池的说法中正确的是
| A.在熔融电解质中O2-由负极移向正极 |
B.电池的总反应是2C4H10+13O2 8CO2+10H2O 8CO2+10H2O |
C.通入空气的一极是正极,电极反应为:O2+4e-+2H2O 4OH- 4OH- |
D.通入丁烷的一极是正极,电极反应为:C4H10-26e-+13O2- 4CO2+5H2O 4CO2+5H2O |
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2- )在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是
| A.有O2参加反应的a极为电池的负极 |
| B.有H2参加反应的b极为电池的正极 |
| C.a极对应的电极反应式为O2 + 2H2O -4e = 4OH- |
| D.该电池的总反应方程式为:2H2+O2 = 2H2O |
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷(C2H6)和氧气,其电极反应式为:C2H6+18OH——14e-=2CO32—+12H2O,2H2O+O2+4e-=4OH—,有关此电池的推断不正确的是 ( )
| A.正极发生还原反应 | B.正极与负极上参加反应的气体的物质的量之比为2∶9 |
| C.通乙烷的电极为负极 | D.电池工作过程中,溶液的pH逐渐减小 |
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是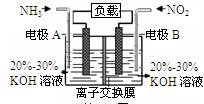
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.A电极上发生氧化反应,B为正极 |
| C.电极A极反应式为2NH3-6e-=N2+6H+ |
| D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol |
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷和氧气,其电极反应式为:C2H6+18OH--14e-=2CO32-+12H2O,2H2O+O2+4e-=4OH-,有关此电池的推断正确的是( )
| A.电池工作过程中,溶液的pH值逐渐减小 |
| B.正极与负极上参加反应的气体的物质的量之比为2:7 |
| C.通乙烷的电极为正极 |
| D.正极发生氧化反应 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
 下列叙述错误的是:
下列叙述错误的是:
| A.放电时正极附近溶液的碱性增强 |
| B.放电时每转移3 mol电子,正极有1mol K2FeO4被还原 |
| C.充电时锌极与外电源负极相连 |
| D.充电时阳极反应为:Fe(OH)3— 3e-+ H2O |
液态肼(N2H4)-空气燃料电池的装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是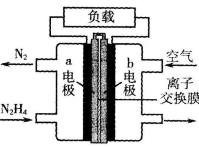
| A.b极发生氧化反应 |
| B.OH-问b极移动 |
| C.放电时,电流从a极经过负载流向b极 |
| D.a极的电极反应式:N2H4+4OH—-4e-=N2↑+4H2O |
将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知,通入 CH4的一极,其电极反应式是CH4+10OH--8e-===CO32-+7H2O;通入O2的另一极,其电极反应式是2O2+4H2O+8e-===8OH-。下列叙述不正确的是
| A.正极发生还原反应 |
| B.通入CH4的电极为负极 |
| C.该电池使用一段时间后应补充KOH |
| D.燃料电池工作时,溶液中的OH-向正极移动 |
观察下列几个装置示意图,有关叙述不正确的是( )

| A.装置①中阴极上析出红色固体 |
| B.装置②的待镀铁制品应与电源负极相连 |
| C.装置③中a为负极,发生的电极反应式为H2+2OH﹣+2e﹣=2H2O |
| D.装置④中在阴极可以得到氢气和氢氧化钠,离子交换膜可选用阳离子交换膜 |
“天宫一号”的供电系统(RFC)是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。右图为RFC工作原理示意图,有关说法正确的是
A.当有0.1 mol电子转移时,a电极产生1.12 L H2
B.b极上发生的电极反应是:4H2O+4e-===2H2↑+4OH-
C.d极上发生的电极反应是:O2+4H++4e-===2H2O
D.c极上发生还原反应,B中的H+通过隔膜进入A
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是
| A.电池放电时Na+从b极区移向a极区 |
| B.电极b采用MnO2,MnO2既作电极材料又有催化作用 |
| C.每消耗1mol H2O2,转移的电子为1mol |
| D.该电池的正极反应为:BH4-+8OH--8e-=BO2-+6H2O |
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
①在标准状况下,每消耗5.6L CH4可以向外电路提供2mole-
②通过甲烷电极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O
③通过甲烷的电极为电池的正极,通过氧气的电极为负极
④电池放电后,溶液pH不断升高
| A.①② | B.①③ | C.①④ | D.③④ |
试题篮
()