(每空2分,16分)
Ⅰ.2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行t1时刻达到平衡状态的是 (填代号)。

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H1=-867 kJ/mol ①
2NO2(g)  N2O4(g) △H2=-56.9 kJ/mol ②
N2O4(g) △H2=-56.9 kJ/mol ②
H2O(g) = H2O(l) ΔH3= -44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:
Ⅱ.A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物。请回答下列问题:
(1)C、D、E三种原子对应的离子半径由大到小的顺序是 (填具体离子符号);A、B、C三种元素按1:7:12的质量比组成的化合物中含有的化学键的类型属于 。
(2)某金属常用于制作易拉罐,该金属制作的废弃易拉罐能与 A、C、D组成的化合物溶液反应,该反应的离子方程式为: 。
(3)A、C两元素的单质与烧碱溶液组成燃料电池,其负极反应式为 ,用该电池电解1L1mol/LNaCl溶液,当消耗标准状况下1.12LA2时, 所得溶液在常温下的PH= (假设电解过程中溶液的体积不变) 。
下面是某课外小组从初选后的方铅矿【主要成分PbS,含少量黄铜矿(CuFeS2)中提取硫磺、铜、铅的工艺流程: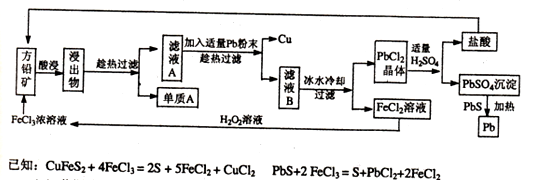
(1)黄铜矿(CuFeS2 )中Fe元素的化合价为 ,提高方铅矿酸浸效率的措施有 (写出两种方法即可)。
(2)过滤过程中用到的玻璃仪器有烧杯、玻璃棒、 ;单质A是 ;在此工艺操作中可循环利用的物质有铅和
(3)在酸性的FeC12溶液中加入H202溶液,其反应的离子方程式为 。
(4)PbS04与PbS加热条件下反应的化学方程式为. .将沉淀PbSO4与足量的碳酸钠溶液混合,沉淀可转化为PbCO3,写出该反应的平衡常数表达式:K= 。(己知Ksp(PbSO4)="1.6x" 10-5,Ksp(PbC03)=3.3x10-14)
(5)铅蓄电池的电极材料分别是Pb和PbO2,电解质溶液为硫酸。铅蓄电池充放电的总反应方程式为:PbO2+Pb+2H2SO4 2PbS04+2H20,充电时,铅蓄电池阳极的电极反应式为 。
2PbS04+2H20,充电时,铅蓄电池阳极的电极反应式为 。
甲醇应用于精细化工,塑料等领域,是基础的有机化工原料和优质燃料。工业上利用H2、CO和CO2等气体体系在催化剂条件下合成甲醇(CH3OH)。主要反应:
①CO(g)+2H2(g)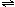 CH3OH(g) △H=-91 kJ·mol—1
CH3OH(g) △H=-91 kJ·mol—1
②CO2(g)+3H2(g)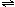 CH3OH(g)+H2O(g) △H=-49 kJ·mol—1
CH3OH(g)+H2O(g) △H=-49 kJ·mol—1
副反应:③2CO(g)+4H2(g)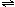 CH3OCH3(g)+H2O(g) △H=-206 kJ·mol—1
CH3OCH3(g)+H2O(g) △H=-206 kJ·mol—1
(1)写出反应②平衡常数的表达式 。
(2)工业上可利用CH3OH(g)制备CH3OCH3(g),写出热化学方程式 。
(3)生产中H2和CO按物质的量比为10:1投料,假设在反应容器中投入1molCO和10molH2在某温度下反应(只考虑反应①),达到平衡后,测得甲醇的物质的量分数为5%,计算CO转化率,写出计算过程。
(4)工业中常用甲醇为燃料制成燃料电池,请写出在KOH(aq)介质中该电池负极的电极反应式 。
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
(1)氢氧燃料电池的能量转化主要形式是______________________,在导线中电子流动方向为_______(用a、b 表示)。
(2)负极反应式为 ___________________。
(3)电极表面镀铂粉的原因为___________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ.2Li+H2 2LiH
2LiH
Ⅱ.LiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是______________,反应Ⅱ中的氧化剂是_____________。
②用锂吸收224L(标准状况)H2,再由生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为__________mol。
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为,另含有少量头铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的
,又制得电池材料
(反应条件已略去)。

请回答下列问题:
(1)上述流程脱硫实现了(选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用能除去溶液中
和
,其原因是。
(3)已知:25℃、101时,
与
反应生成无水
的热化学方程式是。
(4)可作超级电容器材料。用惰性电极电解
溶液可制得
,其阳极的电极反应式是。
(5)是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是。
(6)假设脱除的只与软锰矿浆中的
反应。按照图示流程,将
(标准状况)含
的体积分数为
%的尾气通入矿浆,若
的脱除率为89.6%,最终得到
的质量为
,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于
。
(15分)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成CO,充分燃烧时生成CO2,反应放出的能量如图1所示
(1)在通常状况下, 更稳定(填“金刚石”或“石墨”),金刚石转化为石墨的热化学方程式为 。
(2)CO、O2和熔融Na2CO3可制作燃料电池,其原理见图2。石墨Ⅰ上电极反应式为 。
(3)用CO2生产甲醇燃料的方法为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol,将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图3所示(实线)。图中数据a(1,6)表示:在1min时H2的物质的量是6 mol。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图3所示(实线)。图中数据a(1,6)表示:在1min时H2的物质的量是6 mol。
①下列时间段平均反应速率最大的是 。
| A.0~1min | B.1~3min | C.3~8min | D.8~11min |
②仅改变某一个实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅰ对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 ,体积不变,再充入3molCO2和4molH2,H2O(g)的体积分数 (填“增大”“减小”或“不变”)。
.减少污染、保护环境是全世界最热门的课题。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 (填序号):
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M)总:n(N)总= 。
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 。
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO 还原为N2,一段时间后,溶液的碱性
还原为N2,一段时间后,溶液的碱性
明显增强。则该反应离子方程式为 。
②电化学降解NO 的原理如图所示,电源正极为 (填“a”或“b”);
的原理如图所示,电源正极为 (填“a”或“b”);
若总反应为4NO3-+4H+通电5O2↑+2N2↑+2H2O,则阴极反应式为 。
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。
① 一定条件下,SO2与空气反应t min后,SO2和SO3物质的量浓度分别为a mol/L,b mol/L,则SO2 起始物质的量浓度为_________mol/L;生成SO3的化学反应速率为__________mol/(L • min)。
②工业制硫酸,尾气SO2用__________吸收。
(2)全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:

①当左槽溶液逐渐由黄变蓝,其电极反应式为 。
②充电过程中,右槽溶液颜色逐渐由 色变为 色。
③放电过程中氢离子的作用是 和 ;充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为 。
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效 率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH 溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连 续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
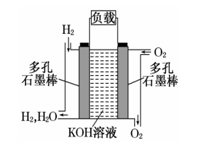
(1)写出氢氧燃料电池工作时负极反应方程式:
负极: 。
(2)为了获得氢 气,除了充分利用太阳能外,工业上利用石油产品与水在高温、催化剂作用下制取氢气.写出丙烷和 H2O 反应生成 H2 和 CO 的化学方程式:
(3)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为 : 电池总离子反应方程式为 。
(4)若将此燃料电池改进为直接以有机物 A 和氧气为原料进行工作,有机物 A 只含有 C、H、 O 三种元素,常用作有机合成的中间体。16.8 g 该有机物经燃烧生成 44.0 g CO2 和 14.4 g H2O ;质谱图表明其相对分子质量为 84,红外光谱分析表明 A 分子中含有 O—H 键和位于分子端的-C≡C-键,核磁共振氢谱有三个峰,峰面积为 6:1:1。A 的分子式是 A的结构简式是
甲醇是重要的化工原料,利用CO2和H2合成甲醇,发生的主反应如下:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H

已知:在25℃、101kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ.请写出表示甲醇燃烧热的热化学方程式 .
(1)在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图1所示.回答:
0~10min 内,氢气的平均反应速率为 mol/(L•min);第10min 后,保持温度不变,向该密闭容器中再充入0.75mol CO2(g)和1.5mol H2O(g),则平衡 (填“正向”、“逆向”或“不”)移动.恒温恒压密闭容器中该反应达平衡状态的依据是(填序号) .
| A.v正(CH3OH)=3v逆(H2) | B.混合气体的密度不变 |
| C.c(CH3OH)=c(H2O) | D.混合气体的总物质的量不变 |
(2)如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL某NaCl溶液,该装置中 a 极为 极,负极反应式为 .在电解一段时间后,NaCl溶液的pH值变为12(假设NaCl 溶液的体积不变),则理论上消耗甲醇的物质的量为 mol.
(3)取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H 0(填“>”、“<”或“=”).
2SO2(g)+O2(g) 2SO3(g) △H=-198kJ/mol,反应过程的能量变化如图所示。
2SO3(g) △H=-198kJ/mol,反应过程的能量变化如图所示。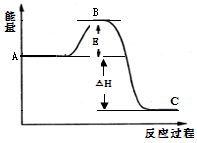
请回答下列问题:
(1)图中A表示__________,该反应加入V2O5作催化剂后E如何变化_______(填“升高”、“降低”或“不变”)。
(2)如果反应速率v(SO2)为0.05mol/(L·min),则v(O2)="_________" mol/(L·min)、v(SO3)=_____mol/(L·min)
(3)已知单质硫燃烧热的数值为296kJ/mol,则1molS(s)完全反应生成SO3(g)时放出的热量为________kJ。
(4)某人设想以如图所示装置用电化学原理生产硫酸,通入O2的一极为_______________(填写“正”或“负”)极;写出通入SO2一极的电极反应____________________。
甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇CO(g)+2H2(g)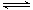 CH3OH(g) ΔH
CH3OH(g) ΔH
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250 ℃ |
300 ℃ |
350 ℃ |
| K |
3.041 |
1.000 |
0.120 |
由表中数据判断ΔH________0 (填“>”、“=”或“<”),化学平衡常数表达式K= ;
(2)300 ℃时,在体积为2.0 L的密闭容器中通入2 mol CO和4 mol H2 ,经过20 s 达到平衡状态,
①计算20 s内CO的反应速率为 ,此时容器中甲醇的体积分数为 ;
②若向上述平衡体系中同时加入1mol CO,2mol H2 和1mol CH3OH气体,平衡移动情况是__________(填“向右”、“向左”或“不移动”),原因是 ;
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH1=-1277.0 kJ/mol
②2CO(g)+O2(g) = 2CO2(g) ΔH2=-566.0kJ/mol
③H2O(g) = H2O(l) ΔH3=-44 kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: ;
(4)甲醇,氧气可制作燃料电池,写出以氢氧化钾为电解质甲醇燃料电池负极反应式 ;如图,电解KI溶液制碘,在粗试管中加入饱和的KI溶液,然后再加入苯,插入一根石墨电极和一根铁电极,使用该燃料电池做电源,铁电极与 极(填正或负)相连接,通电一段时间后,断开电源,振荡试管,上层溶液为 色,当有1.27g 碘单质生成时,需要 g CH3OH。

(1)对工业合成氨条件的探索一直是化学工业的重要课题,在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应,如下图(图中所示数据均为初始物理量)。t分钟后反应均达到平衡,生成NH3均为0.4mol(忽略水对压强的影响及氨气的溶解)。
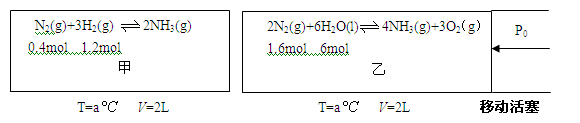
①判断甲容器中的反应达平衡的依据是 .(填写相应编号)
| A.压强不随时间改变 |
| B.气体的密度不随时间改变 |
| C.c(N2)不随时间改变 |
| D.单位时间内生成2molNH3的同时消耗1molN2 |
E.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下甲容器中反应的平衡常数K=
③该条件下,若向乙中继续加入0.2mol N2,达到新平衡时N2转化率= 。
(2)某甲醇(CH3OH)燃料电池原理如图1所示。
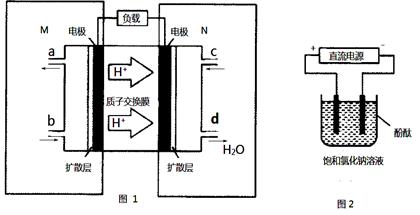
①M区发生反应的电极反应式为_______________________________.
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解池的总反应离子方程式为: . 假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化).
某课外活动小组设想:如果模拟工业上离子交换膜法制烧碱的方法,利用下图实验装置(两电极均为石墨电极)电解 溶液来制取
溶液来制取 、
、 、
、 和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
(1)该电解槽的阳极反应式为 ,此时通过阴离子交换膜的离子数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(2)制得的 溶液从出口 (填“A”、“B”、“C”或“D”)导出。
溶液从出口 (填“A”、“B”、“C”或“D”)导出。
(3)利用制得的氢气为基本原料合成出甲醇,然后再用甲醇与氧气、氢氧化钠组成燃料电池,则该电池负极的电极反应式为 。
(15分)甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____________分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)  CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为____________
②下列选项能判断该反应达到平衡状态的依据的有____________
| A.2v(H2)=v(CH3OH) | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器内的压强保持不变 | D.混合气体的密度保持不变 |
E.混合气体的颜色保持不变 F.混合气体的平均相对分子质量不随时间而变化
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣akJ·mol﹣1
②2CO(g)+O2(g)=2CO2(g) △H=﹣bkl·mol﹣1
③H2O(g)=H2O(1) △H=﹣ckJ·mol﹣1
则CH3OH(1)+O2(g)==CO(g)+2H2O(1) △H=____________kJ·mol﹣1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为____________________________________.
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
| 离子 |
Cu2+ |
H+ |
Cl﹣ |
SO42﹣ |
| c/mol·L﹣1 |
0.5 |
2 |
2 |
0.5 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____________.
试题篮
()