铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为
Fe3++Cr2+ Fe2++Cr3+.下列说法一定正确的是( )
Fe2++Cr3+.下列说法一定正确的是( )

| A.氧化性:Cr3+>Fe3+ |
| B.电池放电时,负极的电极反应式为Fe2+﹣e﹣═Fe3+ |
| C.充电时,阴极的电极反应式为Cr3++e﹣═Cr2+ |
| D.电池放电时,Cl﹣从负极室穿过选择性透过膜移向正极室 |
用图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )

| A.可以用石墨作阳极,铁作阴极 |
| B.阳极的电极反应式为:2CN-+12OH-—10e-=N2↑+2CO32-+6H2O |
| C.阴极的电极反应式为: Cl-+2OH- +2e-=ClO-+H2O |
| D.除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O |
汽车尾气作为空气污染的主要来源之一,其中含有大量的有害物质,包括CO、NOx、碳氢化合物和固体悬浮颗粒等。对汽车尾气的治理使环境工作者面临了巨大的挑战。试回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染。已知:
①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
则由CH4将NO2完成还原成N2,生成CO2和水蒸气的热化学方程式是____________________;
(2)NOx也可被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数Ka=9.7×10-4mol•L-1,NO2-的水解常数为Kh=8.0×10-10mol•L-1,则该温度下水的离子积常数=______(用含Ka、Kh的代数式表示),此时溶液的温度______25℃(“>”、“<”、“=”)。
(3)化工上利用CO合成甲醇,反应的热化学方程式为:CO(g)+2H2(g)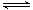 CH3OH(g)△H=-90.8KJ•mol-1。不同温度下,CO的平衡转化率如右图所示:图中T1、T2、T3的高低顺序是________,理由是______。
CH3OH(g)△H=-90.8KJ•mol-1。不同温度下,CO的平衡转化率如右图所示:图中T1、T2、T3的高低顺序是________,理由是______。
(4)化工上还可以利用CH3OH生成CH3OCH3。在体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)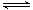 CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
| 容器编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH |
CH3OCH3 |
H2O |
||
| Ⅰ |
387 |
0.20 |
0.080 |
0.080 |
| Ⅱ |
207 |
0.20 |
0.090 |
0.090 |
该反应的正反应为________反应(填“吸热”、“放热”),若起始是向容器Ⅰ中充入CH3OH0.15mol、CH3OCH30.15mol和H2O0.10mol,则反应将向_____方向进行(填“正”、“逆”)。
(5)CH3OH燃料电池在便携式通讯设备、汽车等领域有着广泛的应用。已知电池工作时的总反应方程式为:2CH3OH+3O2=2CO2+4H2O,电池工作时的示意图如右图所示: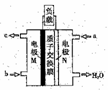
质子穿过交换膜移向_____电极区(填“M”、“N”),负极的电极反应式为________。
某种可充电聚合物锂离子电池放电时的反应为Li1﹣xCoO2 + LixC6 =" 6C" + LiCoO2,其工作原理示意图如图。下列说法不正确的是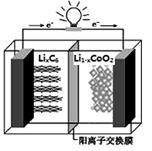
| A.放电时LixC6发生氧化反应 |
| B.充电时将电池的负极与外接电源的负极相连 |
| C.充电时,Li+通过阳离子交换膜从左向右移动 |
| D.放电时,电池的正极反应为:Li1﹣xCoO2+xLi++xe﹣═LiCoO2 |
一种新型燃料电池,一极通入空气,另一极通入丁烷气体,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料的说法正确的是 ( )
| A.在熔融电解质中,OH-由正极移向负极 |
| B.电池的总反应是:2C4H10+13O2→8CO2+10H2O |
| C.通入空气的一极是正极,电极反应为:O2+2H2O +4e-=4OH- |
| D.通入丁烷的一极是正极,电极反应为:C4H10+26 e-+13O2-=4 CO2↑+5 H2O |
LiAl/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:
2Li++FeS+2e-→Li2S+Fe ,有关该电池的下列说法中,正确的是( )
| A.负极的电极反应式为Al-3e-―→Al3+ |
| B.该电池的总反应式为2Li+FeS===Li2S+Fe |
| C.LiAl在电池中作为负极材料,该材料中Li的化合价为+1 |
| D.充电时,阴极发生的电极反应式为Li2S+Fe-2e-===2Li++FeS |
据国外媒体报道,iPhone5在电池方面有所改进,它将配备NEC自主研发的ORB超薄有机游离基电池,单次充电仅需30秒.该电池的一极为一种有机高分子的游离基(用R表示)和石墨粉及粘结剂的复合物,另一极是锂,分隔材料为某种聚烯烃,电解质为LiPF6溶解于某种有机碳酸酯溶剂中,高分子游离基在空气中十分稳定,在电池充电时被氧化成阳离子,而电池放电时又被还原成游离基.下列有关说法不正确的是( )
| A.放电时,该电池是将化学能转化为电能 | B.放电时,负极发生的反应是Li-e-═Li+ |
| C.充电时,Rx+由阴极向阳极移动 | D.充电时,阳极发生的反应是R-xe-═Rx+ |
汽车尾气和燃煤尾气是造成空气污染的原因之一。

(1)汽车尾气净化的主要原理为2N0+2C0→ 2C02+N2。在密闭容器中发生该反应时,c(C02)随温度(T)和时间(t)的变化曲线如图所示。
①T1 (填“>”“<”或“=”)T2
②在T2温度下,0〜2 S内的平均反应速率 (N2)=。
(N2)=。
③若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 。

(2)NH3催化还原氮氧化物(SCR)技术是目前应用广泛的烟气氮氧化物脱除技术。用Fe作催化剂时,在氨气足量的情况下,不同  对应的脱氮率如图所示。
对应的脱氮率如图所示。

脱氮效果最佳的= 。此时对应的脱氮反应的化学方程式为 。
(3)NO2、O2和熔融NaNO3可形成燃料电池,其原理如图所示。该电池在使用过程中石墨I电极上生成N2O5,其电极反应式为 。

短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(一)(1)D在周期表中的位置是 ,写出实验室制备单质F的离子方程式 。
(2)化学组成为BDF2的电子式为: ,A、C、F三种元素形成的化合物CA4F为 化合物(填 “离子”或“共价”)。
(3)化合物甲、乙由A,B,D,E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为: 。
(4)由C,D,E,F形成的简单离子的离子半径由大到小的顺序是 (用元素离子符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性 于F(填“强”或“弱”),并用化学方程式证明上述结论 。
(二)以CA3代替氢气研发氨燃料电池是当前科研的一个热点。
(1)CA3燃料电池使用的电解质溶液是2mol•L﹣1的KOH溶液,电池反应为:4 CA3+3O2=2C2+6H2O.该电池负极的电极反应式为 ;每消耗3.4g CA3转移的电子数目为 。
(2)用CA3燃料电池电解CuSO4溶液,如图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,则B电极上发生的电极反应式为 ;此时向所得溶液中加入8gCuO固体后恰好可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为 L。
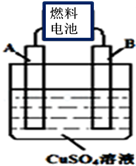
(3)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。

图1 图2
0~t1时,原电池的负极是Al片,此时,正极的电极反应式是 ,溶液中的H+向 极移动(填“正”或“负”),t1时,原电池中电子流动方向发生改变,其原因是 。
Ⅰ.羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫的危害,其分子结构和CO2相似。
(1)羰基硫(COS)的电子式为:______________。
(2)羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:
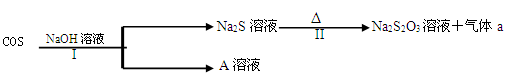
已知A是一种正盐,则A的化学式为______________;若气体a为单质,
反应II的离子方程式为________________________________________________。
Ⅱ.海水中含有丰富的镁资源。锂(Li)与镁元素性质相似。
(1)物质的量为0.10 mol的锂在只含有N2和O2混合气体的容器中燃烧,反应后容器内固体物质的质量m克,m的取值范围是 ;
(2)锂电池是新一代高能电池,目前已研究成功多种锂电池。某离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6 CoO2+LiC6,则放电时电池的正极反应为 。
CoO2+LiC6,则放电时电池的正极反应为 。
(3)为了回收废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂。
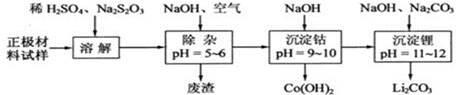
①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中的化学反应方程式为 。
②调整pH=5-6的目的是 。
化学与生产、生活息息相关,下列叙述错误的是( )
| A.碱性锌锰干电池比普通锌锰干电池性能好,比能量和可储存时间均有提高 |
| B.汽车加大油门、把食物放在冰箱里,食品包装袋内放置小包除氧剂,都是为了改变反应物转化率而采取的措施 |
| C.1kg人体脂肪可存储约32200kJ能量,一般人每行走1km大约要消耗170kg能量,如果每天步行5kg,一年(按365天计)中消耗的脂肪大约是9.6kg |
| D.炒菜用铁锅未及时洗净(残余中含NaCl),可能发生电化学腐蚀生成红褪色锈斑 |
在固态金属氧化物电解池中,高温电解H2O﹣CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
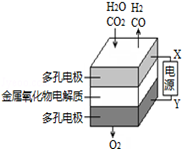
| A.X是电源的负极 |
| B.阴极的反应式是:H2O+2e﹣═H2+O2﹣,CO2+2e﹣═CO+O2﹣ |
C.总反应可表示为:H2O+CO2 H2+CO+O2 H2+CO+O2 |
| D.阴、阳两极生成的气体的物质的量之比是1:1 |
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A.反应CH4+H2O 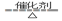 3H2+CO,每消耗1molCH4转移12mol 电子 3H2+CO,每消耗1molCH4转移12mol 电子 |
| B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O |
| C.电池工作时,CO32-向电极B移动 |
| D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
Ⅰ、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的
放电电压。高铁电池的总反应为
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
(1) 放电时正极附近溶液的碱性 (填增强、减小或不变);放电时每转移3 mol 电子,有 molK2FeO4被 (填氧化或还原)
(2)电池充电时阳极反应为
Ⅱ、下列框图中,A由两种黑色金属氧化物等物质的量混合而成,B中含有四种阳离子.据此回答下列问题:

(1)A的组成是(填化学式)
(2)相同条件下,溶液B中所有阳离子的氧化性由强到弱的顺序依次是
(3)A中某组分可由单质与水反应制得,化学方程式为:
(4)电解所用装置如右图所示
电解开始阶段,阳极上的电极反应是
电解至阴极刚开始有固体R析出时,该溶液中金属离子浓度由大到小的顺序是

试题篮
()