二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池,具有很好的发展前景。
(1)已知H2、CO和CH3OCH3的燃烧热(ΔH)分别为-285.5kJ/mol、-283kJ/mol和-1460.0 kJ/mol,则工业上利用水煤气成分按1:1合成二甲醚的热化学方程式为:____________。
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的H2,将悬浮物带到水面,利于除去。实验室以二甲醚燃料电池模拟该方法设计的装置如下图所示:
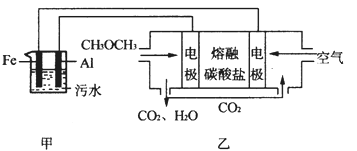
①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极。写出该燃料电池的正极电极反应式__________________;下列物质可用做电池熔融碳酸盐的是______。
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)2CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式____________________。
③已知常温下Ksp[Fe(OH)3]=4.0×10-38,电解一段时间后,甲装置中c(Fe3+)= ___________。
④已知:H2S的电离平衡常数:K1=9.1×10-8、K2=1.1×10-12;H2CO3的电离平衡常数:K1=4.31×10-7、K2=5.61×10-11。测得电极上转移电子为0.24mol时,将乙装置中生成的CO2通入200mL 0.2mol/L的Na2S溶液中,下列选项正确的是______
A.发生反应的离子方程式为:CO2+S2-+H2O=CO32-+H2S
B.发生反应的离子方程式为:CO2+S2-+H2O=HCO3-+HS-
C.c(Na+)=2[c(H2S)+c(HS-)+c(S2-)
D.c(Na+)+c(H+)=2c(CO32-)+2c(S2-)+c(OH-)
E.c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
微生物燃料电池(Microbial Fuel Cell,MFC)是一种利用微生物将有机物中的化学能直接转化成电能的装置。最早用于有机废水处理,下图是利用微生物燃料电池处理含甲醛废水的装置,其中3是质子交换膜,下列有关说法不正确的是
A.负极发生的反应为:HCHO-4e-+H2O=CO2+4H+
B.负极所在的左室中需保持厌氧环境
C.O2参与正极反应,发生还原反应
D.NH4+通过循环操作最终被转化成N2
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1﹣xCoO C6+LiCoO2。下列说法不正确的是
C6+LiCoO2。下列说法不正确的是
| A.据题意分析可知该隔膜只允许Li+通过,放电时 Li+从左边流向右边 |
| B.充电时,A为阴极,发生还原反应 |
| C.放电时,B为正极,电极反应式为:Li1﹣xCoO2+xLi++xe﹣=LiCoO2 |
| D.废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质。下列分析不正确的是
| A.电子经外电路流向Pt电极 |
| B.电池工作时,电解质中Ag+数目减少 |
| C.正极反应:Cl2+2e—+2Ag+ = 2AgCl |
| D.空气中c(Cl2)越大,Ag极消耗速率越快 |
根据题意完成下列方程式
(1)写出实验室制备氨气的化学方程式 ;
(2)写出实验室制备Cl2的离子方程式 ;
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;K2FeO4-Zn可组成碱电池,电池总反应式为:2Fe O42-+8H2O+3Zn=2Fe(OH)3+3Zn(OH)2+4OH-。写出该电池的正极反应式 ;
Al-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,则下列说法正确的是
| A.当电极上析出0.54 g Ag时,电路中转移的电子为0.01 mol |
B.该隔膜是阳离子交换膜 |
| C.Al电极的反应式为:Al-3e-+3OH-=Al(OH)3 |
| D.正极的电极反应式为:AgO+2e-+2H+=Ag+H2O |
(1)可以将氧化还原反应2H2+O2=2H2O设计成原电池,若KOH溶液作电解质溶液,则正极反应式为 。若把H2改为甲烷,KOH溶液作电解质溶液,则负极反应式为 。
(2)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH。该电池的正极反应式为 ,负极反应式为 ,电池反应的离子方程式为: 。
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列叙述正确的是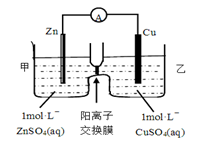
| A.铜电极上发生氧化反应 |
| B.电池工作一段时间后,甲池的c(SO42-)减小 |
| C.电池工作一段时间后,乙池溶液的总质量增加 |
| D.阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
为充分利用海洋资源,研究人员发明海水电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列说法错误的是
| A.负极反应式: Ag+Cl-e-=AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na2Mn5O10是还原产物 |
| D.Cl-不断向电池的正极移动 |
大功率Al H2O2动力电池原理如图所示,下列说法不正确的是

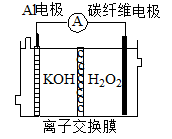
| A.电池组成中Al电极是负极 |
| B.OH-从碳纤维电极透过离子交换膜移向Al电极 |
| C.碳纤维电极的电极反应是H2O2+2e-+2H+=2H2O |
| D.该电池反应的离子方程式是2Al+3H2O2+2OH-=2Al(OH)4- |
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2。下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
| D.电池充电过程中,阴极附近溶液的pH降低 |
电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
| A.锌锰干电池工作一段时间后碳棒变细 |
| B.氢氧燃料电池可将热能直接转变为电能 |
| C.在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 |
| D.太阳能电池的主要材料是高纯度的二氧化硅 |
金属-硫电池价格低廉,使用寿命较长,能量密度高,因而在电池研究领域得到广泛关注。最近,我国科研工作者研究了一种能在室温下工作的新型Na-S电池。该电池放电过程的总反应方程式如下:nS + 2Na = Na2Sn
注:能量密度指单位质量的电极材料可输出的电能,以W·h·kg-1为计量单位。
则下列说法不正确的是( )
| A.该电池中用固态金属Na为负极,S单质作为正极,但S单质须负载在导电材料上 |
| B.该电池的电解质必须具备室温下传导Na+的能力,但不宜用NaOH溶液作为电解液 |
| C.n值越大则该电池的能量密度越高 |
| D.该电池充电过程中阳极的电极反应式:Na2Sn-2e-=2Na++ nS,故充电时Na+从阳极向阴极迁移 |
用酸性甲醛燃料电池为电源进行电解的实验装置如图所示,下列说法中正确的是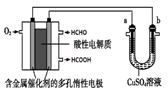
| A.当a、b都是铜做电极时,电解的总反应方程式为: 2CuSO4+2H2O 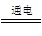 2H2SO4+2Cu+O2↑ 2H2SO4+2Cu+O2↑ |
| B.燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH— |
| C.当燃料电池消耗2.24L 甲醛气体时,电路中理论上转移2mole- |
| D.燃料电池工作时,负极反应为:HCHO+ H2O—2e-=HCOOH + 2H+ |
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
请回答下列有关含氮物质的问题:
(1)右图是1molNO2和1molCO反应生成CO2 和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_____________________________________;
恒温恒容条件下,不能说明该反应已达到平衡状态的是___(填序号)。
| A.容器内混合气体颜色不再变化 |
| B.容器内的压强保持不变 |
| C.v逆(NO2)=v正(NO) |
| D.容器内混合气体密度保持不变 |
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g) 2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。
2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。
该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应_______(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。总电池反应为N2H4+O2 = N2+2H2O。该电池放电时,负极的电极反应式是_________。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式_____________________________________。
试题篮
()