关于化学电源的叙述,错误的是( )
| A.化学电源均是根据原电池的工作原理设计的 |
| B.在干电池中,碳棒只起导电作用,并不参加化学反应 |
| C.镍镉电池不能随意丢弃的主要原因是镍、镉的资源有限,价格昂贵 |
| D.燃料电池是一种高效、环保的新型化学电源 |
用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为( )
| A.22.4ax/b | B.11.2ax/b |
| C.5.6ax/b | D.2.5ax/b |
氢氧燃料电池所耗原料为H2和O2,电极为多孔镍,电解质溶液为30%的KOH溶液。下列有关叙述正确的是( )
| A.负极反应为O2+4e-+2H2O====4OH- |
| B.正极反应为2H2+4OH--4e-====4H2O |
| C.工作时正极区pH升高,负极区pH降低 |
| D.工作时,溶液中阴离子移向正极 |
用惰性电极电解100 mL饱和食盐水,一段时间后在阴极得到112 mL H2(标准状况),此时电解液(体积变化忽略不计)的pH为( )
| A.13 | B.12 | C.8 | D.1 |
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内是离子“流过”水和氧化锌组成的电解液。电池总反应为:Zn + 2 MnO2十H2O =" ZnO" + 2MnO (OH)。下列说法正确的是
| A.该电池的正极为锌 |
| B.电池正极反应式为: 2MnO2 + 2e-+ 2H2O =" 2MnO" (OH)十2OH- |
| C.当 0.l mol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023 |
| D.该电池反应中二氧化锰起催化作用 |
燃料电池是燃料(如CO,H2,CH4等)跟氧气(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱溶液,下面关于甲烷燃料电池的说法正确的是( )
| A.负极反应式:O2+2H2O+4e-=4OH- |
| B.负极反应式:CH4+8OH--8e-=CO2↑+6H2O |
| C.随着放电的进行,溶液的pH值不变 |
| D.放电时溶液中的阴离子向负极移动 |

C2H5OH+3O2=2CO2+3H2O,电池示意如图。下列说法中,正确的是
| A.电池工作时,质子向电池的负极迁移 |
| B.电池工作时,电流由b极沿导线流向a极 |
| C.a极上发生的电极反应是: C2H5OH+3H2O+12e-=2CO2+12H+ |
| D.b极上发生的电极反应是:4H++O2+4e-=2H2O |
银锌电池的充电和放电过程可表示为: 2Ag+Zn(OH)2 Ag2O+Zn+2H2O,此电池放电时,负极上发生反应的物质是( )
Ag2O+Zn+2H2O,此电池放电时,负极上发生反应的物质是( )
| A.Ag | B.Zn(OH)2 | C.Ag2O | D.Zn |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2+H2O(l)====Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2+H2O(l)+2e-====Mn2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2 mol电子,锌的质量理论上减小了6.5 g |
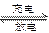
| A.电池放电时,电池负极周围溶液的pH 不断增大 |
| B.电池充电时,阳极反应为:Ni(OH)2 + OH- -e-=" NiO(OH)" +H2O |
| C.电池充电时,氢元素被还原 |
| D.电池放电时,负极反应为:H2-2e-=2H+ |
乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意如图。下列说法中,错误的是
| A.电池工作时,质子向电池的正极迁移 |
| B.电池工作时,电流由b极沿导线流向a极 |
| C.a极上发生的电极反应是:C2H5OH+3H2O+12e-=2CO2+12H+ |
| D.b极上发生的电极反应是:4H++O2+4e-=2H2O |
铅蓄电池在现代生活中具有广泛的应用。已知铅蓄电池的电解质溶液为H2S04溶液,其充电、放电按下式进行:Pb+PbO2+2H2SO4 2PbSO4+2H2O,有关该电池的说法正确的是
2PbSO4+2H2O,有关该电池的说法正确的是
| A.充电时化学能转化为电能 |
| B.放电时溶液中的H+向负极移动 |
| C.充电时电池的正极与电源的正极相连 |
| D.放电时负极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
电子表所用的某种纽扣电池的电极材料为Zn和Ag2O,电解质溶液是KOH溶液。电池总反应式为:Zn+Ag2O="ZnO+2Ag," 下列说法错误的是
| A.该电池的正极是Zn,负极是Ag2O |
| B.该电池负极的电极反应式为:Zn+2OH——2e—=ZnO+H2O |
| C.理论上该电池工作一段时间后,溶液中KOH的浓度不变 |
| D.该电池工作时,电解质中的阴离子向负极移动 |
铅蓄电池的两极分别为Pb、PbO2,电解液为H2SO4,工作时的反应为Pb+PbO2+2H2SO4 2PbSO4+2H2O,下列结论正确的是( )
2PbSO4+2H2O,下列结论正确的是( )
| A.Pb为正极被氧化 | B.溶液的pH不断减小 |
C. 只向PbO2处移动 只向PbO2处移动 |
D.电解液密度不断减小 |
试题篮
()