下图装置中,A为铅蓄电池,C1、C2为石墨电极,B烧杯中是浓度均为0.1mol/L的H2SO3和KI的混合溶液100mL。下列说法正确的是 
| A.铅蓄电池工作一段时间后,A中溶液的PH变小 |
| B.当B烧杯中I-的浓度降为0.05mol/L时,A中消耗的 H2SO3的物质的量为0.025mol |
| C.当C1、C2两极均开始产生气体时,至少已有3.6×1022个电子从电路中流过 |
| D.铅蓄电池工作时,负极电极反应式为:PbO2-2e -+ H2SO3 =PbSO4+2H2O +SO42- |
电池是一种正在开发的车载电池,该电池中正极的电极反应式为:
;有关该电池的下列说法中,正确的是
| A. |
|
| B. |
该电池的电池反应式为:
|
| C. |
负极的电极反应式为
|
| D. |
充电时,阴极发生的电极反应式为:
|
铅蓄电池的工作原理为: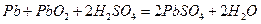 研读 如图,下列判断不正确的是
研读 如图,下列判断不正确的是
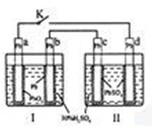
A.K 闭合时,d电极反应式: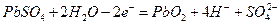 |
B.当电路中转移0.2mol电子时,I中消耗的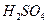 为0.2 mol 为0.2 mol |
C.K闭合时,II中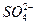 向c电极迁移 向c电极迁移 |
| D.K闭合一段时间后,II可单独作为原电池,d电极为正极 |
下列说法不正确的是
| A.铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
B.常温下,反应 不能自发进行,则该反应的 不能自发进行,则该反应的 |
| C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
D.相同条件下,溶液中 、 、 、 、 的氧化性依次减弱 的氧化性依次减弱 |
如图是一种航天器能量储存系统原理示意图。下列说法正确的是
| A.该系统中只存在3种形式的能量转化 |
B.装置Y中负极的电极反应式为: |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
某固体酸燃料电池以
固体为电解质传递
,其基本结构见下图,电池总反应可表示为:
,下列有关说法正确的是

| A. | 电子通过外电路从 极流向 极 |
| B. | 极上的电极反应式为: |
| C. | 每转移0.1 电子,消耗1.12 的 |
| D. | 由 极通过固体酸电解质传递到 极 |
氢—氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:2H2+4OH--4e-===4H2O和O2+2H2O+4e-===4OH- 。则下列叙述正确的是:
| A.通H2的一极是正极,通O2的一极是负极 |
| B.通O2的一极是正极,通H2的一极是负极 |
| C.工作一段时间后电解质溶液pH增大 |
| D.工作时正极区附近pH减小 |
阿波罗号宇宙飞船上使用的氢氧燃料电池,其电池反应为:2H2+O2=2H2O ,电解质溶液为KOH溶液,反应保持在较高温度,使H2O蒸发,则下列叙述中正确的是( )
| A.此电池能发生蓝色火焰 |
| B.H2为正极,O2为负极 |
| C.工作时,电解质溶液的pH不断减小 |
| D.电极反应分别为负极:2H2+4 OH――4e-=4 H2O;正极:O2+2 H2O+4e-=4 OH- |
肼(N2H4)—空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%~30%的KOH
溶液。电池总反应为:N2H4+O2=N2↑+2H2O。下列关于该燃料电池工作时的说法正确的是
| A.负极的电极反应式是:N2H4+4OH--4e-=4H2O+N2↑ | |
| B.正极的电极反应式是:O2+4H++4e-=2H2O | |
| C.溶液中阴离子向正极移动 | D.溶液中阴离子物质的量浓度基本不变 |
直接NaBH4/H2O2燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是
A.电极B材料中包含MnO2层,MnO2可增强导电性
B.电池负极区的电极反应为:
BH4 + 8OH
+ 8OH —8e
—8e = BO
= BO + 6H2O
+ 6H2O
C.放电过程中,Na+从正极区向负极区迁移
D.在电池反应中,每消耗1L 6 mol/LH2O2溶
液,理论上流过电路中的电子为6NA个
铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O根据上述情况判断:
(1)蓄电池的负极是______,其电极反应式为______。
(2)蓄电池的正极是______,其电极反应式为______。
(3)蓄电池工作时,其中电解质溶液的pH______(增大、减小、不变)。
(4)实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是 。
试题篮
()