人工光合系统装置(如图)可实现以CO2和H2O合成CH4。下列说法不正确的是
| A.该装置为原电池,且铜为正极 |
| B.电池工作时,H+向Cu电极移动 |
| C.GaN电极表面的电极反应式为:2H2O-4e-=O2+4H+ |
D.反应CO2+2H2O CH4+2O2中每消耗1molCO2转移4mole- CH4+2O2中每消耗1molCO2转移4mole- |
依据原电池原理,回答下列问题:
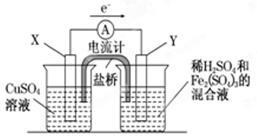
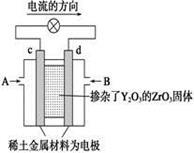
图(1) 图(2)
(1)图(1)是依据氧化还原反应:Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)设计的原电池装置。
①电极X的材料为是 ;电极Y的材料为是 。
②Y电极发生的电极反应式为: 。
(2)图(2)是使用固体电解质的燃料电池,装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e―→2O2-)。
① c电极的名称为 ②d电极上的电极反应式为 。
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
Ⅰ.将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度 /mol.L-1 |
4×10-5 |
6×10-5 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5的酸碱性,试样的pH=_________。
Ⅱ.NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
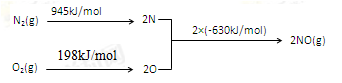
①N2(g)+O2(g) 2NO(g)△H=________。
2NO(g)△H=________。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式___。
2CO(g)═2C(s)+O2(g),已知该反应的△H>0,该设想不能实现,他的依据是_______。
Ⅲ.碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
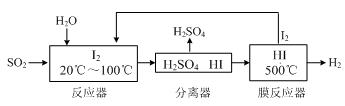
①用离子方程式表示反应器中发生的反应___________________________。
②用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池.电池充放电时的总反应为:Ni(OH)2+M  NiO(OH)+MH,电池放电时,负极电极反应式为:________________________。
NiO(OH)+MH,电池放电时,负极电极反应式为:________________________。
液流电池是一种新型可充电的高性能蓄电池,其工作原理如下图。两边电解液存储罐盛放的电解液分别是含有V3+、V2+的混合液和VO2+、VO2+酸性混合液,且两极电解液分开,各自循环。下列说法不正确的是( )

| A.充电时阴极的电极反应是V3++e-=V2+ |
| B.放电时,VO2+作氧化剂,在正极被还原,V2+做还原剂,在负极被氧化 |
| C.若离子交换膜为质子交换膜,充电时当有1mol e-发生转移时,左槽电解液的H+的物质的量增加了1mol |
| D.若离子交换膜为阴离子交换膜,放电时阴离子由左罐移向右罐 |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是( )
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
| C.电池反应的化学方程式为:CH3CH2OH+O2=CH3COOH+H2O |
| D.正极上发生的反应是:O2+4e-+2H2O=4OH- |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 下列叙述不正确的是( )
下列叙述不正确的是( )
| A.放电时负极反应为:Zn-2e- +2OH-= Zn(OH)2 |
| B.充电时阳极反应为:Fe(OH)3-3e-+5OH-= FeO42-+4H2O |
| C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
可以将反应Zn+Br2 = ZnBr2设计成蓄电池,下列4个电极反应①Br2 + 2e-= 2Br-
②2Br- - 2e-= Br2 ③Zn – 2e-= Zn2+ ④Zn2+ + 2e-= Zn其中表示充电时的阳极反应和放电时的负极反应的分别是( )
| A.②和③ | B.②和① | C.③和① | D.④和① |
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该项燃料电池说法正确的是 ( )
| A.在熔融电解质中,O2-移向正极 |
| B.电池总反应式是:2C4H10+13O2→8CO2+10H2O |
| C.通入空气的一极是正极,电极反应为:O2+2 H2O+ 4e-=4OH- |
| D.通入丁烷的一极是正极,电极反应为:C4H10+26e-+13O2-==4CO2+5H2O |
碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,下列说法错误的是( )
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2+2H2O+2e-=2MnOOH+2OH- |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2 mol 电子,锌的质量理论上减少6.5 g |
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)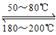 Ni(CO)4(g),△H<0;
Ni(CO)4(g),△H<0;
利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是_______(填字母编号)。
| A.增加Ni的量可提高CO的转化率,Ni的转化率降低 |
| B.缩小容器容积,平衡右移,△H减小 |
| C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低 |
| D.当4v正[Ni(CO)4]=v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
(2)CO与镍反应会造成含镍催化剂的中毒.为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫.
已知:CO(g)+ 1/2O2(g)=CO2(g) △H=-Q1 kJ•mol-1
S(s) +O2(g) =SO2(g) △H=-Q2 kJ•mol-1
则SO2(g) +2CO(g) ="S(s)" +2CO2(g) △H=________________;
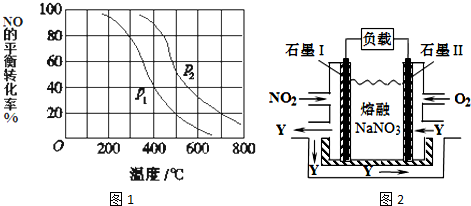
(3)对于反应:2NO(g)+O2═2NO2(g),向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图1).
①比较P1、P2的大小关系_______________;
②700℃时,在压强为P2时,假设容器为1L,则在该条件平衡常数的数值为_______(最简分数形式);
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图2所示.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为_______________;若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为________L。
短周期元素A、B、C、D、E,A为原子半径最小的元素,A、D同主族,D、E同周期,CE同主族且E的原子序数为C的原子序数的2倍,B为组成物质种类最多的元素。
(1)E离子的原子结构示意图__________________;
(2)分别由A、C、D、E四种元素组成的两种盐可相互反应得到气体,写出这个反应的离子方程式__________________;
(3)由A、B、C三种元素组成的物质X,式量为46,在一定条件下与C、D两种元素的单质均可反应.写出X与C单质在红热的铜丝存在时反应的化学方程式__________________;
(4)A、C、D三种元素组成的化合物Y中含有的化学键为_______________,B的最高价氧化物与等物质的量的Y溶液反应后,溶液显________(“酸”、“碱”或“中”)性,原因是________________;
(5)A的气体单质和C的气体单质可发生反应,在“神舟六号”飞船上使用了根据这反应设计的燃料电池,电解质溶液为KOH溶液,电池负极反应为__________,使用这种电池的优点为_____________;
如图所示装置Ⅰ是一种可充电池,装置Ⅱ为电解池,离子交换膜只允许Na+通过,充放电的化学方程式为Na2S4+3NaBr 2Na2S2+NaBr3.闭合开关K时,b极附近先变红色.下列说法正确的是( )
2Na2S2+NaBr3.闭合开关K时,b极附近先变红色.下列说法正确的是( )

| A.负极反应为4Na-4e-═4Na+ |
| B.闭合K后,b电极附近的pH变小 |
| C.当有0.01mol Na+通过离子交换膜时,b电极上析出标准状况下的气体112mL |
| D.闭合K后,a电极上产生的气体具有漂白性 |
已知蓄电池在充电时作电解池,放电时作原电池,铅蓄电池上的两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”,关于标有“+”的接线柱,下列说法中正确的是
| A.充电时作阳极,放电时作负极 |
| B.充电时作阳极,放电时作正极 |
| C.充电时作阴极,放电时作负极 |
| D.充电时作阴极,放电时放正极 |
可用于电动车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
| A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH- |
| B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓ |
| C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 |
| D.电池工作时,电子通过外电路从正极流向负极 |
试题篮
()