(1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义。为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为 。
若以该电池为电源,用石墨做电极电解100 mL含有如下离子的溶液。
| 离子 |
Cu2+ |
H+ |
Cl- |
SO42- |
| c/mol·L-1 |
1 |
4 |
4 |
1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气标况下的体积为 L。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程:
①写出阳极电极反应式 ;
②除去甲醇的离子反应为 ,该过程中被氧化的元素是_____ ,当产生标准状况下2.24 L CO2时,共转移电子 mol。
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.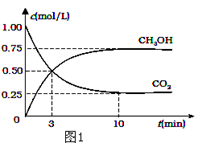
(1)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为2L的恒容密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=___mol/(L•min);
②氢气平衡时的物质的量浓度为___________;
③下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是___________.
| A.升高温度 |
| B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 |
| D.再充入1mol CO2和3mol H2 |
④当反应达到平衡时, H2的物质的量浓度为c1,然后向容器中再加入1mol CH3OH和1mol H2O,待反应再一次达到平衡后,H2的物质的量浓度为c2.则c1______c2的关系(填>、<、=).
(2)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标.如图2所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.将其插入KOH溶液从而达到吸收CO2的目的.请回答: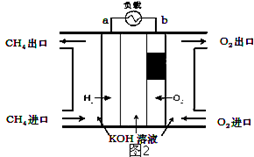
①通入甲烷一极的电极反应式为___________;
②随着电池不断放电,电解质溶液的pH______(填“增大”、“减小”或“不变”).
③通常情况下,甲烷燃料电池的能量利用率___________(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.
(1)已知N≡N、N﹣H、H﹣H的键能分别为946kJ•mol﹣1、390kJ•mol﹣1、436kJ•mol﹣1.试根据盖斯定律,写出合成氨反应的热化学方程式__________________________________________。
(2)在通常状况下,足量氢氧化钠的稀溶液与含溶质为1mol的稀硫酸完全反应时放出akJ的热量,写出该反应中和热的热化学方程式______________________________________________________。
(3)以镁和铝为电极,以NaOH作电解质溶液,构成原电池时,铝做负极,其电极反应式为__________;
与MnO2﹣Zn电池类似,K2FeO4﹣Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,在反应中还原产物为Fe(OH)3 ,则正极电极反应式为__________________________________________。
已知:锂离子电池的总反应为: C+LiCoO2;锂硫电池的总反应为:2Li+S
C+LiCoO2;锂硫电池的总反应为:2Li+S Li2S有关上述两种电池说法正确的是( )
Li2S有关上述两种电池说法正确的是( )

| A.锂离子电池放电时,Li+向负极迁移 |
| B.锂硫电池充电时,锂电极发生还原反应 |
| C.理论上两种电池的比能量相同 |
| D.右图中表示用锂离子电池给锂硫电池充电 |
全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为V2+-e-=V3+,下列说法正确的是( )

| A.放电时,右槽发生还原反应 |
| B.放电时,左槽电解液pH升高 |
| C.充电时,阴极的电极反应式:VO2++2H++e-=VO2++H2O |
| D.充电时,每转移1 mol电子,n(H+)的变化量为1 mol |
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠.已知该电池放电时的电极反应式为:正极 FePO4+Li++e﹣=LiFePO4; 负极 Li﹣e﹣=Li+下列说法中正确的是( )
| A.充电时电池反应为FePO4+Li=LiFePO4 |
| B.充电时动力电池上标注“+”的电极应与外接电源的负极相连 |
| C.放电时电池内部Li+向正极移动 |
| D.放电时,在正极上是Li+得电子被还原 |
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)═CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ/mol
CH3CH=CH2(g)═CH4(g)+HC≡CH(g)△H2=+32.4kJ/mol
则相同条件下,反应C3H8(g)═CH3CH=CH2(g)+H2(g)的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH =5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二步电离,则H2CO3 HCO3-+H+的平衡常数K1= mo1/L。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= mo1/L。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mo1/L NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用简要的文字明)。
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A.反应CH4+H2O 3H2+CO,每消耗1molCH4转移12mol 电子 3H2+CO,每消耗1molCH4转移12mol 电子 |
| B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O |
| C.电池工作时,CO32-向电极B移动 |
| D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
 温度/℃ 温度/℃化合物 |
0 |
20 |
40 |
60 |
80 |
100 |
| NH4Cl |
29.3 |
37.2 |
45.8 |
55.3 |
65.6 |
77.3 |
| ZnCl2 |
343 |
395 |
452 |
488 |
541 |
614 |
| 化合物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp近似值 |
10-17 |
10-17 |
10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为:
(2)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A.反应CH4+H2O 3H2+CO,每消耗1molCH4转移12mol 电子 3H2+CO,每消耗1molCH4转移12mol 电子 |
| B.电极A上H2参与的电极反应为: H2+2OH--2e-=2H2O |
| C.电池工作时,CO32-向电极B移动 |
| D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量不减少,请回答下列问题:
(1)M电极的组成元素在周期表中的位置是_________________,电极名称是__________,加入乙醇的铂电极的电极反应式为________________,写出乙池中发生的化学反应的离子式________________;
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为____________L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的pH为________;
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量表示该反应的热化学方程式为________________;
(4)甲烷也是一种很好的清洁能源.蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体.甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol.356g“可燃冰”(若分子式为CH4•9H2O)释放的甲烷气体完全燃烧生成液态水.放出的热量为__________kJ;
科学家们在研制一种吸气式的锂—空气电池,工作时吸收空气中的氧气在多孔金制成的正极表面上反应。总反应可表示为2Li+O2 Li2O2下列有关说法正确的是
Li2O2下列有关说法正确的是
| A.充电时,多孔金制成的电极外接电源负极 |
| B.放电时,Li+从负极向正极移动 |
| C.放电时,吸收空气中22.4 L的O2,就有2 mol e-从电池负极流出 |
| D.该电池可使用含Li+的水溶液作电解质溶液 |
一种充电电池放电时的电极反应为H2+2OH--2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-当为电池充电时,与外电源正极相连接的电极上发生的反应是( )
| A.H2O的还原 | B.NiO(OH)的还原 |
| C.H2的氧化 | D.Ni(OH)2的氧化 |
银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可表示为:2Ag+Zn(OH)2 Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是( )
Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是( )
| A.Ag | B.Zn(OH)2 | C.Ag2O | D.Zn |
试题篮
()