近期发现, 是继NO、CO之后第三个生命体系气体信号分子,它具有参与调解神经信号传递、舒张血管减轻高血压的功能.回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是(填标号).
| A. | 氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 |
| B. | 氢硫酸的导电能力低于相同浓度的亚硫酸 |
| C. | 的氢硫酸和亚硫酸的pH分别为4.5和2.1 |
| D. | 氢硫酸的还原性强于亚硫酸 |
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理.

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________、________,制得等量H 2所需能量较少的是________.
(3) 与 在高温下发反应:生 .在610k时,将 与 充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02.
① 的平衡转化率 =________%,反应平衡常数K=________.
②在620K重复试验,平衡后水的物质的量分数为0.03, 的转化率 ________ , 该反应的△H________0.(填">""<"或"=")
③向反应器中再分别充入下列气体,能使 转化率增大的是________(填标号)
| A. |
|
B. |
|
C. |
COS |
D. |
|
砷(As)是第四周期VA族元素,可以形成 、 、 、 等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图__________。
(2)工业上常将含砷废渣(主要成分为 )制成浆状,通入 氧化,生成 和单质硫。写出发生反应的化学方程式__________。该反应需要在加压下进行,原因是__________。
(3)已知:
则反应 的 __________。
(4)298K时,将 、 和 溶液混合,发生反应: 。溶液中 与反应时间(t)的关系如图所示。
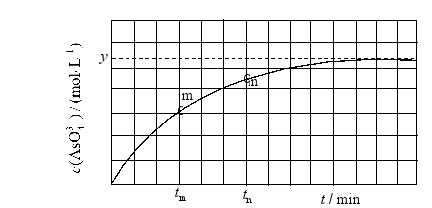
①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.
c. 不再变化
d.
② 时, __________ (填"大于"、"小于"或"等于")。
③ 时 __________ 时 (填"大于"、"小于"或"等于"),理由是__________。
④若平衡时溶液的 ,则该反应的平衡常数K为__________。
在湿法炼锌的电解循环溶液中,较高浓度的 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入 和 ,生成 沉淀从而除去 。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )
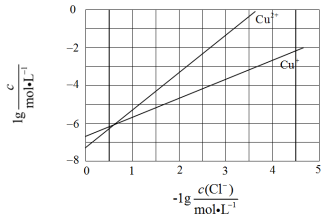
A. 的数量级为
B.除 反应为
C.加入 越多, 浓度越高,除 效果越好
D. 平衡常数很大,反应趋于完全
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为: 。下图为刚性容器中,进料浓度比 c(HCl) ∶ 分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
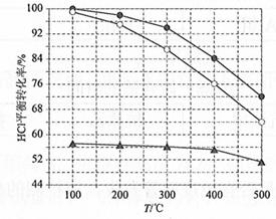
可知反应平衡常数 K(300℃)________ K(400℃)(填"大于"或"小于")。设HCl初始浓度为 , 根据进料浓度比 c(HCl)∶ c(O 2)=1∶1的数据计算 K(400℃)=________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比 c(HCl)∶ 过低、过高的不利影响分别是________。
(2)Deacon直接氧化法可按下列催化过程进行:
Δ
Δ
Δ
则 的 Δ H=________ 。
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
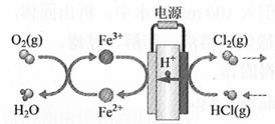
负极区发生的反应有________(写反应方程式)。电路中转移1 mol电子,需消耗氧气________L(标准状况)
【化学ーー选修2:化学与技术】
高锰酸钾( )是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为 )为原料生产高锰酸钾的工艺路线如下:
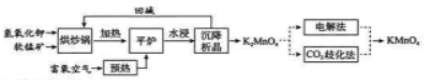
回答下列问题:
(1) 原料软锰矿与氢氧化钾按 的比例在 "烘炒锅"中混配,混配前应将软锰矿粉碎, 其作用是 。
(2) "平炉"中发生的化学方程式为 .
(3)"平炉"中需要加压,其目的是 。
(4) 将 转化为 的生产有两种工艺。
① 歧化法" 是传统工艺, 即在 溶液中通入 气体, 使体系呈中性或弱碱性,
发生歧化反应,反应中生成 和 (写化学式)。
② "电解法" 为现代工艺, 即电解 水溶液, 电解槽中阳极发生的电极反应为 , 阴极逸出的气体是_ 。
③ "电解法" 和 歧化法" 中, 的理论利用率之比为 _ 。
(5)高锰酸钾纯度的测定:称取 样品, 溶解后定容于 容量瓶中, 摇匀。取浓度为 的 标准溶液 , 加入稀硫酸酸化,用 溶液平行滴定三次, 平均消耗的体积为 , 该样品的纯度为 。
(列出计算式即可, 已知 ) 。
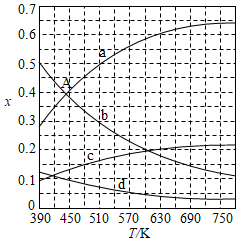
二氧化碳催化加氢合成乙烯是综合利用CO 2的热点研究领域。回答下列问题:
(1)CO 2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C 2H 4):n(H 2O)= 。当反应达到平衡时,若增大压强,则n(C 2H 4) (填"变大""变小"或"不变")。
(2)理论计算表明。原料初始组成n(CO 2):n(H 2)=1:3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。图中,表示C 2H 4、CO 2变化的曲线分别是 、 。 CO 2催化加氢合成C 2H 4反应的△H 0 (填"大于"或"小于")。
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数K p= (MPa) ﹣ 3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C 3H 6、C 3H 8、C 4H 8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当 。
反应SiCl4(g)+2H2(g) Si(s)+4HCl(g)可用于纯硅的制备。下列有关该反应的说法正确的是( )
A.该反应△H>0、△S<0
B.该反应的平衡常数K
C.高温下反应每生成1mol Si需消耗2×22.4L H2
D.用E表示键能,该反应△H=4E(Si﹣Cl)+2E(H﹣H)﹣4E(H﹣Cl)
某弱酸HA溶液中主要成分的分布分数随pH的变化如图所示。下列说法错误的是( )

A.该酸﹣lgKa≈4.7
B.NaA的水解平衡常数Kh
C.当该溶液的pH=7.0时,c(HA)<c(A﹣)
D.某c(HA):c(A﹣)=4:1的缓冲溶液,pH≈4
试题篮
()