探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=﹣49.5 kJ•mol﹣1
Ⅱ.CO(g)+2H2(g)⇌CH3OH(g)△H2=﹣90.4 kJ•mol﹣1
Ⅲ.CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3
回答下列问题:
(1)△H3= kJ•mol﹣1。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1mol CO2和3mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为bmol,此时H2O(g)的浓度为 mol•L﹣1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为 。
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。
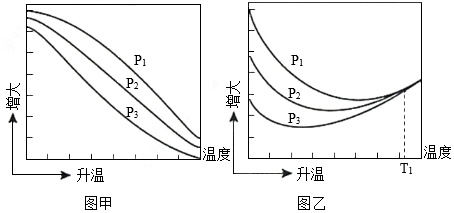
已知:CO2的平衡转化率 100%
CH3OH的平衡产率 100%
其中纵坐标表示CO2平衡转化率的是图 (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为 ;图乙中T1温度时,三条曲线几乎交于一点的原因是 。
(4 )为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为 (填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
二氧化碳催化加氢合成乙烯是综合利用CO 2的热点研究领域。回答下列问题:
(1)CO 2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C 2H 4):n(H 2O)= 。当反应达到平衡时,若增大压强,则n(C 2H 4) (填"变大""变小"或"不变")。
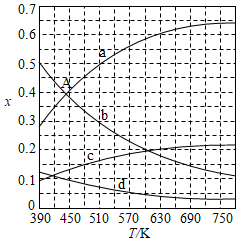
(2)理论计算表明。原料初始组成n(CO 2):n(H 2)=1:3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。图中,表示C 2H 4、CO 2变化的曲线分别是 、 。 CO 2催化加氢合成C 2H 4反应的△H 0 (填"大于"或"小于")。
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数K p= (MPa) ﹣ 3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C 3H 6、C 3H 8、C 4H 8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当 。
试题篮
()