改变 二元弱酸 溶液的pH,溶液中的 、 、 的物质的量分数 随pH的变化如图所示[已知 ]。

下列叙述错误的是( )
| A. |
时, |
| B. |
|
| C. |
时, |
| D. |
时, |
高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
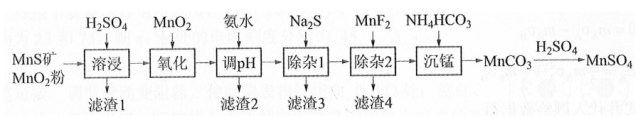
相关金属离子[ ]形成氢氧化物沉淀的pH范围如下:
| 金属离子 |
|
|
|
|
|
|
|
| 开始沉淀的pH |
8.1 |
6.3 |
1.5 |
3.4 |
8.9 |
6.2 |
6.9 |
| 沉淀完全的pH |
10.1 |
8.3 |
2.8 |
4.7 |
10.9 |
8.2 |
8.9 |
(1)"滤渣1"含有S和________;写出"溶浸"中二氧化锰与硫化锰反应的化学方程式________。
(2)"氧化"中添加适量的 的作用是将________。
(3)"调pH"除铁和铝,溶液的pH范围应调节为________~6之间。
(4)"除杂1"的目的是除去 和 , "滤渣3"的主要成分是________。
(5)"除杂2"的目的是生成 沉淀除去 。若溶液酸度过高, 沉淀不完全,原因是________。
(6)写出"沉锰"的离子方程式________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 , 其中Ni、Co、Mn的化合价分别为+2、+3、+4。当 时, z=________。
设
为阿伏加德罗常数值。关于常温下pH=2的
溶液,下列说法正确的是( )
A. 每升溶液中的 数目为
B.
C. 加水稀释使电离度增大,溶液pH减小
D. 加入 固体,溶液酸性增强
常温下将NaOH溶液添加到己二酸( )溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
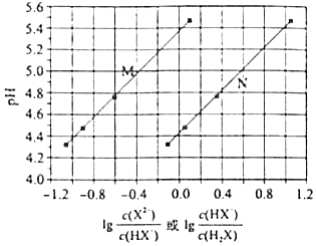
| A. | 的数量级为 |
| B. | 曲线N表示pH与 的变化关系 |
| C. | NaHX溶液中 |
| D. | 当混合溶液呈中性时, |
溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾
的
,
)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )

A.混合溶液的导电能力与离子浓度和种类有关
B. 与 的导电能力之和大于 的
C.b点的混合溶液
D.c点的混合溶液中,
HA是一元弱酸,难溶盐 的饱和溶液中 随 而变化, 不发生水解。实验发现, 时 为线性关系,如图中实线所示。下列叙述错误的是( )
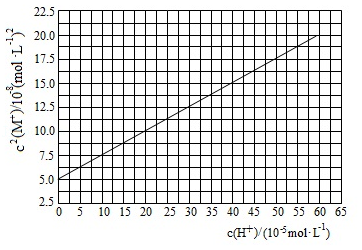
| A. |
溶液 时, |
| B. |
的溶度积 |
| C. |
溶液 时, |
| D. |
HA的电离常数 |
在25℃时某混合溶液中c(CH3COOH)+c(CH3COONa)=0.1mol/L,lgc(CH3COOH)、lgc(CH3COO﹣)、lgc(H+)和lgc(OH﹣)随pH变化关系如图所示。Ka为CH3COOH的电离常数,下列说法正确的是( )
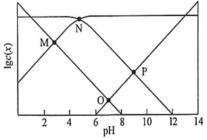
A.O点时,c(CH3COOH)=c(CH3COO﹣)
B.N点时,pH=1gKa
C.该体系中,c(CH3COOH) mol•L﹣1
D.pH由7到14的变化过程中,CH3COO﹣的水解程度始终增大
以酚酞为指示剂,用0.1000mol•L ﹣ 1的NaOH溶液滴定20.00mL未知浓度的二元酸H 2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积V NaOH的变化关系如图所示。[比如A 2 ﹣的分布系数:δ(A 2 ﹣) ]
下列叙述正确的是( )

A.曲线①代表δ(H 2A),曲线②代表δ(HA ﹣)
B.H 2A溶液的浓度为0.2000mol•L ﹣ 1
C.HA ﹣的电离常数K a=1.0×10 ﹣ 2
D.滴定终点时,溶液中c(Na +)<2c(A 2 ﹣)+c(HA ﹣)
室温下,将两种浓度均为0.10mol•L﹣1的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是( )
A.NaHCO3﹣Na2CO3混合溶液(pH=10.30):c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)
B.氨水﹣NH4Cl混合溶液(pH=9.25):c(NH4+)+c(H+)=c(NH3•H2O)+c(OH﹣)
C.CH3COOH﹣CH3COONa混合溶液(pH=4.76):c(Na+)>c(CH3COOH)>c(CH3COO﹣)>c(H+)
D.H2C2O4﹣NaHC2O4混合溶液(pH=1.68,H2C2O4为二元弱酸):c(H+)+c(H2C2O4)═c(Na+)+c(C2O42﹣)+c(OH﹣)
试题篮
()